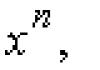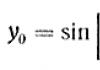Самые важные функции натрия в организме
Наиболее важная жизнеобеспечивающая функция натрия в организме – это поддержание в норме осмотического давления. Речь идет о том, что для проникновения различных молекул сквозь клеточную мембрану необходимо регулировать давление в межклеточной жидкости и внутри самой клетки. Под действием этого давления молекулы питательных веществ проникают внутрь, а при смене давления продукты жизнедеятельности клетки выходят наружу. Регулируют колебания жидкостного давления ионы натрия. Из всего имеющегося в организме натрия около половины этого вещества содержится в межклеточной жидкости. Примерно 10% приходится на внутриклеточное содержимое, а остальное – включено в состав костной ткани и хрящевой.
Натрий способен не только регулировать движение воды в организме, но и удерживать ее для предотвращения обезвоживания клеток и тканей. Вот почему при избытке этого элемента появляется отечность. Натрий принимает участие в синтезе гормонов вазопрессина – увеличивающего объем жидкости в клетках и суживающего сосуды. А также натрийуретических пептидов – выводящих избыток жидкости из организма, расслабляя при этом сосудистые стенки. Синтез гормона адреналина тоже контролируется натрием.
Еще одна важная функция натрия – он принимает участие в формировании канальцев в клеточных мембранах, сквозь которые внутрь клетки поступают необходимые ей вещества. Он же отвечает за проникновение глюкозы в клетки, чтобы снабжать их энергией. От него зависит тонус сосудистых стенок и возбудимость нервно-мышечных волокон.
Без натрия нарушится выработка в желудке соляной кислоты, а значит – все процессы пищеварения. Этот элемент активизирует выработку пищеварительных ферментов, многих энзимов – особых белков, которые отвечают за важные химические реакции в организме (например, выработку ферментов поджелудочной железы, жирных кислот в печени). Щелочной характер натрия важен для поддержания рН-баланса в организме. Натрий – важнейший элемент для бесперебойной работы почек по выполнению их выводящей функции.
Полезные и приятные свойства натрия

С уровнем содержания натрия в организме напрямую связаны заболевания, развивающиеся из-за колебаний артериального давления. Поскольку этот элемент отвечает за спазмы и расслабление сосудов, то его недостаток может вызвать гипотонию, а избыток – провоцирует артериальную гипертензию. Следствием дисбаланса натрия в организме может стать стенокардия, нарушение работы почек, сбой в обмене веществ, проблемы с пищеварением. Избыток натрия может активизировать склеивание эритроцитов крови, повышая склонность к образованию тромбов. Продолжительный избыток натрия в крови значительно повышает риск неврозов, остеопороза, мочекаменной болезни и сахарного диабета.
Польза натрия для организма напрямую связана с его свойствами и выполняемыми функциями:
- предотвращает мышечные спазмы;
- регулирует работу сосудов;
- не допускает перегревания организма за счет стимуляции повышенного потоотделения;
- помогает связывать и выводить углекислый газ из тканей;
- отвечает за переваривание пищи за счет активизации ферментов и участия в выработке желудочного сока;
- влияет на передачу нервных импульсов и функционирование мозга;
- помогает сохранить в растворимом виде в крови кальций .
Хлорид натрия нашел широкое применение как антибактериальное средство. Его включают в состав зубных паст и ополаскивателей для полости рта. Лаурилсульфат и лауретсульфат натрия – важные компоненты шампуней, гелей для душа и других гигиенических средств, которые обладают как поверхностно-активными свойствами, так и антимикробным действием. В состав мыла обычно включаются соединения солей натрия и жирных кислот – стеариновой, лауриновой и пальмитиновой.
Говоря о пользе натрия, нельзя не вспомнить о его участии в поддержании молодости кожи за счет сохранения ее увлажненности. Натриевая соль гиалуроновой кислоты – один из наиболее популярных компонентов увлажняющей и антивозрастной косметики. Ее молекулы имеют маленький размер и способны проникать в дерму, не только увлажняя кожу за счет притягивания молекул воды, но и за счет стимулирования ферментов, отвечающих за выработку собственной гиалуроновой кислоты. Аскорбил фосфат натрия – вещество, обладающее свойствами антиоксиданта, способное стимулировать ферменты, отвечающие за синтез белков (например, коллагена) и препятствующие выработке меланина (а значит – появлению гиперпигментации).
«Вкусно» и «невредно»: правильный баланс натрия из продуктов

Наш организм не вырабатывает натрий самостоятельно. Все количество этого элемента, без которого невозможна жизнь, поступает извне с продуктами питания. Натрий настолько широко распространен в природе, что при регулярном сбалансированном питании его вполне достаточно для работы всех органов и систем.
Самый простой способ снабдить свой организм натрием – съесть чайную ложку соли или выпить минеральной воды с хлоридом натрия (к примеру, «Боржоми» - уровень натрия указывается на этикетке). Но традиционно мы получаем натрий из твердой пищи – хлеба, сыра, соленой рыбы, мясных продуктов, соленых овощей и квашеных
Чемпионами по содержанию натрия считаются обитатели океанских и морских вод – мидии, креветки, лобстеры, крабы, морские раки. Много натрия в морской капусте и в соевом соусе.
Примерный уровень содержания натрия в распространенных продуктах питания (мг на 100 г)
| Мясные и молочные продукты | Рыба, морепродукты | Овощи | Фрукты | ||||
| Молоко коровье | 120 | Раки морские | 380 | Капуста квашеная | 800 | Бананы | 54 |
| Телятина | 100 | Мидии | 290 | Фасоль стручковая | 400 | Черная смородина | 34 |
| Свинина | 80 | Камбала | 200 | Свекла | 260 | Абрикосы | 31 |
| Курятина | 80 | Креветки | 150 | Цикорий | 160 | Яблоки | 27 |
| Говядина | 78 | Сардины | 140 | Шпинат | 85 | Сливы | 19 |
| Творог | 30 | Кальмары | 110 | Картофель | 30 | Апельсины | 14 |
| Соленая сельдь | 4800 | Кукурузные хлопья | 660 |
| Колбаса копченая | 2180 | Ржаной хлеб | 620 |
| Колбаса п/к | 1630 | Майонез «Провансаль» | 510 |
| Оливки маринованные | 1145 | Тунец в масле | 502 |
| Колбаса вареная | 1050 | Томаты консервированные | 480 |
| Сыр твердый | 998 | Тушенка говяжья | 440 |
| Свиные сардельки | 962 | Батон хлеба | 435 |
| Шпроты в масле | 629 | Горошек консервированный | 360 |
Совет! В жаркую погоду при интенсивной потере натрия с потоотделением быстро восстановят его недостаток рыбные консервы – например, тунец, скумбрия в масле. Сбалансировать избыток натрия помогут кисломолочные продукты
Некоторые исследования показали, что в этнических группах с культурой ежедневного потребления молочных продуктов (не менее 600 г в день) существенно реже развивается артериальная гипертензия, связанная с избытком натрия в организме.
Натрий можно получить из любых продуктов и напитков с пищевыми добавками – глутаматом натрия, нитритом натрия, бензоатом натрия и т.п. В любых консервах содержатся и поваренная соль и пищевые добавки с натрием.
Попадая с продуктами в организм, натрий начинает частично всасываться уже в желудке, но основная его часть усваивается в тонком кишечнике. Избыток элемента выводится в основном с мочой (95% натрия экскретируется почками) и калом, хотя при обильном потоотделении выведение через кожу может стать значимым фактором потери натрия.
Усвоение натрия может ухудшиться при рационе, состоящем преимущественно из белковой пищи или из соленых блюд. Улучшают усвоение элемента витамин К и витамин Д. Сохранить баланс калия и натрия в крови поможет достаточное количество в меню животных продуктов. Чем больше продуктов с натрием, тем быстрее выводится из организма магний и кальций.
Хорошая сочетаемость натрия с другими питательными веществами основывается на щелочной природе этого элемента. По мнению диетологов, продукты с высоким содержанием натрия (например, овощи, фрукты) желательно сочетать в рационе с продуктами, создающими кислую среду – с высоким содержанием фосфора, хлора, серы (к примеру, рыба, яйца).
Для того чтобы сохранить натрий в продуктах, не следует их замачивать или долго размораживать перед приготовлением, поскольку натрий легко вступает в реакции с водой и теряется. Лучше всего натрий сохраняется при непродолжительном запекании или тушении, поскольку не реагирует на высокие температуры, а при варке продуктов переходит в бульон. При хранении на свету в открытом состоянии продукты утрачивают натрий, который окисляется на воздухе.
Лучше много или мало – определение нормы натрия

Учитывая легкость получения натрия из продуктов и возможность коррекции его содержания в организме при помощи изменений в диете, существуют разные трактовки ежесуточной нормы потребления элемента. Так, к примеру, Американская ассоциация сердечных заболеваний считает минимально необходимой дозой для взрослых 500 мг/день, а максимальной – 1500 мг. Российское исследование, посвященное профилактике артериальной гипертензии, однозначно показало, что гарантией от развития этого заболевания является ежедневное потребление натрия не более 52 ммоль/сут (около 2,5 г). Потребление свыше 100-120 ммоль/сут (примерно 5,5 г) значительно повышает риск эссенциальной артериальной гипертензии (средний уровень потребления натрия, например, у москвичей составляет 161 ммоль/сут).
По нормам всемирной организации здравоохранения (ВОЗ), для снижения риска инсультов и предупреждения заболеваний сердца, связанных с повышенным артериальным давлением, рекомендуется употреблять с пищей не больше 2 г натрия в день (5 г соли).
Ориентировочные нормы потребления натрия (мг/сут)
Нормы употребления натрия повышаются для людей, выполняющих тяжелую физическую работу, для спортсменов во время тренировок, для тех, кто сильно потеет из-за жаркой погоды или принимает мочегонные средства. Дополнительный натрий нужен при пищевых отравлениях, сопровождающихся сильной рвотой и поносом.
Есть и неофициальные расчеты – на 1 л выпитой в сутки воды можно съесть 1 г соли (половина чайной ложки). При этом нужно помнить о содержании натрия в продуктах питания, о добавлении соли в супы и другие готовые блюда, и учитывать это количество.
Сложность такого учета и становится причиной того, что переизбыток натрия у современных людей встречается значительно чаще, чем дефицит.
Избыток натрия в организме развивается, чаще всего, из-за злоупотребления солью в рационе, а также может быть вызван:
- нарушением питьевого режима (когда человек много двигается и работает, но мало пьет воды);
- неумеренным потреблением соленых продуктов;
- частым употреблением чипсов, сухариков и орешков: прочих снэков, в которых много соли;
- сильной рвотой и поносом без компенсации потерянной жидкости;
- длительным приемом Кортизона и других гормональных препаратов для лечения коры надпочечников;
- хроническими болезнями почек, когда нарушено функционирование почечных фильтров и натрий задерживается в организме.
Причиной передозировки натрия бывает сахарный диабет и избыточная выработка надпочечниковых гормонов (синдром Кушинга), нарушение водно-солевого обмена.
Опасность передозировки натрия в том, что он ускоряет выведение калия из организма, а калий отвечает за снабжение мозга кислородом, за нормализацию ритма сердца и выделительные функции почек. Гипернатриемия проявляется судорогами, повышенной возбудимостью, сильным сердцебиением, повышенной температурой тела, сильными отеками, поскольку почки не справляются с выведением избытка натрия. Резко увеличивается масса тела, повышается артериальное давление, значительно возрастает риск развития инсульта.
Опасности дисбаланса содержания натрия

Дисбаланс натрия может привести к довольно серьезным последствиям для здоровья – вызвать отклонения в работе нервной и сердечно-сосудистой систем, нарушить пищеварение, стать причиной дисфункции почек, расстройства кровообращения, скопления жидкости в легких. Некоторые исследования показали, что повышенное содержание натрия в рационе ведет к риску развитию катаракты (в связи с повышением глазного давления), отказ от соли становится причиной снижения выработки инсулина и повышает синтез гормона ренина, влияющего на возникновение внезапных инсультов и инфарктов.
Проявления дисбаланса натрия в организме
|
Недостаток натрия |
Переизбыток натрия |
|
| Дыхательная система | Дефицит кислорода, проявляющийся синюшностью кожи | Тяжелая одышка, остановка дыхания |
| Органы пищеварения | Тошнота и рвота, кишечные колики, непрекращающееся слюноотделение | Сильная жажда, шершавый язык, сухость во рту |
| Сердце и сосуды | Снижение давления, тахикардия, склонность к сосудистому коллапсу | Высокое давление, отечность |
| Нервная система | Головные боли, головокружение, общая слабость, апатия, мышечные подергивания, иногда расстройства сознания | Повышенная возбудимость, гиперактивность, судороги в мышцах, беспокойство |
| Кожа | Холодная на ощупь, липкая, утратившая эластичность, высыпания на коже, выпадение волос | Покраснение кожи, клейкость слизистых оболочек |
Симптомы недостаточности натрия объясняются уменьшением его количества во внеклеточной жидкости. Главная опасность продолжительного дефицита натрия в том, что в организме начинают усиленно накапливаться соединения азота, что грозит серьезными последствиями вплоть до смертельного исхода.
Факторы, которые могут способствовать развитию дефицита натрия:
- диета с ограничением соли или отказом от нее;
- злоупотребление кофе (кофеин является слабым диуретиком);
- злоупотребление мочегонными средствами, клизмами (в том числе с водой);
- избыточное употребление воды (она способна сильно «разбавить» натрий);
- сильное потоотделение, в том числе при высокой температуре;
- сильная рвота и понос;
- заболевания печени (цирроз), надпочечников, нарушение синтеза антидиуретического гормона, эндокринные нарушения;
- травмы, ожоги и хирургические операции (натрий концентрируется в области поврежденных клеток).
Употребление продуктов с высоким содержанием калия тоже ускоряет выведение натрия, поэтому требует коррекции диеты.
Совет! В жаркую погоду при сильном потоотделении, особенно на пляже при горячем солнце, избежать дефицита натрия и предотвратить тепловой удар поможет 0,5 л слегка подсоленной воды (можно минеральной хлоридной без газа – например, «Миргородской)
Недостаток натрия может долго компенсироваться самим организмом за счет извлечения его из костной ткани. Однако часто повторяющиеся инфекционные заболевания, апатия и повышенная утомляемость, нарушение равновесия при передвижении, утрата аппетита и ощущения вкуса еды, необъяснимое снижение веса – все эти признаки могут свидетельствовать о развивающемся дефиците натрия. Если не принять меры, может начаться интенсивный распад белков, нарушение осмотического давления, повышение остаточного азота. В такой ситуации даже выпитая чистая вода в большом количестве может стать причиной смерти.
При резком снижении уровня натрия в организме могут развиться судороги, а избыток – спровоцировать потерю ориентации в пространстве.
Дисбаланс натрия корректируется изменением рациона и питьевого режима. Если недостаточность натрия невелика – надо пить меньше воды и пересмотреть рацион в пользу продуктов с высоким содержанием натрия (например, морепродуктов, морской капусты), чтобы восполнить дефицит элемента в организме. Если натрия многовато – нужно, прежде всего, ограничить соль в рационе. В более серьезных случаях врач может рекомендовать при дефиците натрия - лекарства, способствующие выделению жидкости или, наоборот, при избытке элемента - отменить препараты, удерживающие в крови натрий. В тяжелых случаях переизбытка натрия может понадобиться внутривенное введение бессолевого раствора, а затем – чтобы предотвратить риск гипонатриемии – раствора хлорида натрия.
Лекарственные препараты с содержанием натрия

Влияние натрия на множество процессов в организме обусловило широкий перечень препаратов, которые применяются при различных патологиях. Рассмотрим некоторые из них, особенно часто применяемые.
Хлорид натрия (хлористый натрий). Применяют при сильной рвоте, тяжелом поносе, обильном диурезе или повышенном потоотделении, при значительных ожогах. Выпускается в порошках, таблетках и ампулах, но чаще всего применяется для внутривенного введения.
Гидрокарбонат натрия (двууглекислый натрий). Применяют при интоксикациях организма, инфекционных заболеваниях, а также в качестве нейтрализатора кислоты (в том числе при повышенной кислотности желудка). При ацидозе или инфекциях назначается в таблетках, при интоксикации – внутривенно. При стоматитах или при попадании кислот на слизистые оболочки – в виде раствора для промываний.
Борат натрия (бура). Антисептик наружного применения, выпускается в виде мазей, растворов для полосканий.
Сульфат натрия (глауберова соль). Применяют как слабительное средство: 15 г для взрослого растворить в стакане воды, действовать начнет через 4 часа.
Тиосульфат натрия (серноватистокислый натрий). Используется как десенсибилизатор и противовоспалительное средство: при аллергиях, невралгиях, артрите - внутривенно, при чесотке – наружно в виде раствора для примочек.
Нитрит натрия (натрий азотистокислый). Применяют как сосудорасширяющее средство при стенокардии, спазмах мозговых сосудов. Выпускается в виде раствора, который можно использовать для инъекций или внутрь – 0,1 г 2-3 раза в день.
Метамизол натрия. Обладает обезболивающим действием, применяется при острых респираторных инфекциях и в качестве жаропонижающего средства. Выпускается в таблетках и ампулах.
Фторид натрия. Широко применяется в стоматологии, поскольку обладает способностью влиять на регенерацию тканей зубов и созревание зубной эмали, обладает противомикробным действием. Используется как в инъекционной, так и в топической форме – в растворах, ополаскивателях и даже в составе лечебной зубной пасты.
Оксибутират натрия. Обладает седативным и миорелаксантным действием, в большой дозе может вызвать состояние сна, активирует обменные процессы в тканях мозга и сердца. Выпускается в виде порошков.
Практически все препараты с содержанием натрия обладают разными побочными эффектами, поэтому их применение обязательно должно быть согласовано с врачом.
Сколько соли мы должны употреблять в день, чтобы не навредить здоровью? Как разобраться в том, где содержится соль в магазинных продуктах и как она скрыта в виде пищевых натриевых добавок? В чем скрытая угроза натрия для организма, поступающего в виде соли? Ответы на эти и другие вопрос смотрите в видео ниже.
Натроном первоначально называли гидроксид натрия. В 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы - калий и натрий, назвав их потассий (Potassium) и содий (Sodium). Берцелиус, и затем Гесс в России предложили названия Natrium / Натрий, которое и закрепилось.
Нахождение в природе, получение:
В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав различных соединений. Наиболее важным является соединение натрия с хлором NaCl, которое образует залежи каменной соли (Донбасс, Соликамск, Соль-Илецк и др.). Хлорид натрия содержится также в морской воде и соляных источниках. Натрий относится к числу распространенных элементов. Содержание натрия в земной коре составляет 2,64%.
Получают электролизом расплавленного хлорида натрия или гидроксида натрия. Применяется также и восстановление его оксидов, хлоридов, карбонатов алюминием, кремнием, кальцием, магнием при нагревании в вакууме.
Физические свойства:
Натрий - серебристо-белый металл, его плотность - 0,97 г/см 3 , очень мягкий, легко режется ножом. Между атомами металлическая связь. Для вещества с такой связью характерны металлический блеск, пластичность, мягкость, хорошая электрическая проводимость и теплопроводность.
Химические свойства:
Атом натрия при химическом взаимодействии легко отдает валентные электроны, переходя в положительно заряженный ион. На воздухе быстро окисляется, поэтому его хранят под слоем керосина.
При сгорании в избытке кислорода образует пероксид натрия, Na 2 O 2
С водородом при нагревании образует гидрид Na + H 2 = 2NaH
Легко взаимодействует со многим неметаллами - галогенами, серой, фосфором и др.
Бурно реагирует с водой:
2Na + 2H 2 O = 2NaOH + H 2
Важнейшие соединения:
Оксид натрия
, Na 2 O (бесцветный), реагирует с парами воды, углекислым газом, потому хранить лучше в безводном бензоле.
При непосредственной реакции натрия с кислородом получается смесь оксида и пероксида натрия. Для получения чистого оксида можно использовать реакцию: Na 2 O 2 + 2Na = 2Na 2 O
Пероксид натрия
, Na 2 O 2 (желтый) кристаллическое вещество с ионной решеткой, взаимодействует с влажным углекислым газом воздуха, выделяя кислород:
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Гидроксид натрия
, NaOH - кристаллическое белое вещество, сравнительно легкоплавкое, термически очень устойчиво. При нагревании испаряется без потери воды. Хорошо растворяется в воде, в спиртах.
Галогениды натрия
, бесцветные кристаллические вещества, хорошо растворимы в воде, за исключением NaF. Для них характерны восстановительные свойства.
Сульфид натрия
, - Na 2 S. Бесцветное кристаллическое вещество с ионной решеткой. Хорошо растворимо в воде, является сильным восстановителем.
Соли
, все соли хорошо растворимы, являются сильными электролитами.
Гидрид натрия
, NaH - бесцветное кристаллическое вещество с кристаллической решеткой типа NaCl, анионом является H - . Получают пропусканием водорода над расплавленными металлом. Подвергается термической диссоциации не плавясь, легко разлагаются водой:
2NaH = 2Na + H 2
NaH + H 2 O = NaOH + H 2
Применение:
Соединения натрия - важнейшие компоненты химических производств. Используются в мыловарении, производстве стекла, средств бытовой химии.
Натрий важен для большинства форм жизни, включая человека. В живых организмах ионы натрия вместе с ионами калия выполняют функцию передатчиков нервного импульса. Также его ионы играют важную роль в поддержании водного режима организма.
Бондарева Мария Александровна
ХФ ТюмГУ, 561 группа.
Источники: Г.П. Хомченко "Пособие по химии для поступающих в ВУЗы"
"Неорганическая химия в схемах и таблицах"
Неорганическое вещество, простой элемент таблицы Менделеева, входит в группу щелочных металлов. Занимает шестое место по распространенности в земной коре; его больше всего среди металлов, растворенных в водах морей и океанов. В виде соединений встречается в таких минералах, как галит, мирабилит, тенардит, натриевая селитра , трона, бура и пр. В чистом виде не встречается.
Промышленный способ получения: электролиз расплава хлористого натрия (поваренной соли). Одновременно получают натрий и хлор.
Свойства
Пластичный металл серебристого цвета. На воздухе быстро окисляется и тускнеет. Мягкий настолько, что его можно резать скальпелем, прокатывать, прессовать. Легче воды. Хорошо проводит ток и тепло. Цвет пламени окрашивает в ярко-желтый цвет. Эта реакция является характерной для обнаружения многих соединений натрия.
Относится к химически очень активным металлам, обладает осно́вными свойствами. Вступает в реакцию с кислородом, углекислым газом, разбавленными и концентрированными кислотами, спиртами, газообразным и жидким аммиаком , оксидами. Самовоспламеняется при взаимодействии с хлором и фтором, бурно реагирует с водой (иногда - со взрывом), бромом, серой. Вступает в реакции практически со всеми неметаллами (иногда для этого требуются особые условия, электроразряд или высокая температура). С водой образует сильную щелочь - гидроокись натрия (едкий натр). Образует соединения со ртутью и некоторыми другими металлами, с органическими веществами.
У натрия весьма существенная разница между температурами плавления и кипения - почти 800 градусов. Плавитcя он при t около +98 °С, кипит при t +883 °С. Благодаря этому свойству из натрия получается хороший теплоноситель для мощных атомных реакторов, не закипающий до высоких температур.
 Натрий играет большую роль в жизни живых организмов. Он необходим для нормального обмена веществ, работы нервной и сердечно-сосудистой систем. Недостаток натрия приводит к нарушениям работы ЖКТ, судорогам, невралгиям. Переизбыток - к отекам, повышению давления, проблемам в работе почек.
Натрий играет большую роль в жизни живых организмов. Он необходим для нормального обмена веществ, работы нервной и сердечно-сосудистой систем. Недостаток натрия приводит к нарушениям работы ЖКТ, судорогам, невралгиям. Переизбыток - к отекам, повышению давления, проблемам в работе почек.
Меры предосторожности
Натрий нельзя брать руками, так как он тут же вступает в реакцию с влагой кожи и образует щелочь, вызывая сильные химические и термические ожоги.
Хранят натрий под слоем керосина или минерального масла в герметичных железных контейнерах (жидкость должна полностью покрывать реактив). Если хранят в стеклянной емкости, то ее, в свою очередь, нужно поместить в несгораемый металлический шкаф.
После работы с металлическим натрием остатки следует нейтрализовать спиртом, ни в коем случае не допуская попадания частиц натрия в мусорное ведро или канализацию, поскольку это может вызвать пожар и быстрое разрушение канализационных труб.
Применение
Восстановительные свойства используются при получении  чистых металлов: калия, циркония, тантала и др.
чистых металлов: калия, циркония, тантала и др.
В газоразрядных лампах.
В металлургии натрий добавляют в сплавы свинца для придания им прочности. Сплавы других металлов он делает более тугоплавкими.
В электротехнике натрий используется для изготовления энергоемких аккумуляторов, клапанов двигателей грузовиков, шин для очень высоких токов.
Так как натрий плохо поглощает нейтроны, он применяется в качестве теплоносителя в атомных реакторах на быстрых нейтронах.
Для осушения орг.растворителей, для качественного анализа в органической химии.
Изотопы натрия применяется в медицине и научных исследованиях.
В пищепроме применяются многие соли: глутамат, хлорид, гидрокарбонат, бензоат, нитрит, сахаринат натрия.
Поваренная соль используется в водоочистке.
Гидроокись натрия востребована в производстве бумаги, мыла, синтетических волокон; как электролит.
Карбонаты и гидрокарбонаты натрия применяются в пожаротушении, фармацевтике.
Фосфат натрия необходим для изготовления моющих средств, красок, в стекольной индустрии, фотоделе.
Силикаты натрия используются в производстве огне- и кислотоупорных бетонов.
Применение находят азид, цианид, хлорат, пероксид, тетраборат, сульфат, тиосульфат натрия и многие другие его соединения.
Стоит ли после всего этого удивляться не прекращающемуся росту производства натрия?
Заканчиваем наш рассказ об элементе № 11 словами Дмитрия Ивановича Менделеева, написанными много лет назад, но вдвойне справедливыми для наших дней: «Получение металлического натрия относится к важнейшим открытиям в химии не потому одному, что через то расширилось и стало более правильным понятие о простых телах, но потому особенно, что в натрии видны химические свойства, лишь слабо выраженные в других общеизвестных металлах».
Подробный рассказ о химических свойствах натрия опущен по той причине, что это один из немногих разделов химии, которые достаточно полно излагаются в школьных учебниках.
- НАТРИЙ НА ПОДВОДНОЙ ЛОДКЕ. Na плавится при 98, а кипит только при 883°С. Следовательно, температурный интервал жидкого состояния этого элемента достаточно велик. Именно поэтому (и еще благодаря малому сечению захвата нейтронов) натрий стали использовать в ядерной энергетике как теплоноситель. В частности, американские атомные подводные лодки оснащены энергоустановками с натриевыми контурами. Тепло, выделяющееся в реакторе, нагревает жидкий натрий, который циркулирует между реактором и парогенератором. В парогенераторе натрий, охлаждаясь, испаряет воду, и полученный нар высокого давления вращает паровую турбину. Для тех же целей используют сплав натрия с калием.
- НЕОРГАНИЧЕСКИЙ ФОТОСИНТЕЗ. Обычно при окислении натрия образуется окись состава Na 2 O. Однако если сжигать натрий в сухом воздухе при повышенной температуре, то вместо окиси образуется перекись Na 2 O 2 . Это вещество легко отдает свой «лишний» атом кислорода и обладает поэтому сильными окислительными свойствами. Одно время перекись натрия широко применяли для отбелки соломенных шляп. Сейчас удельный вес соломенных шляп в использовании перекиси натрия ничтожен; основные количества ее используются для отбелки бумаги и для регенерации воздуха на подводных лодках. При взаимодействии перекиси натрия с углекислым газом протекает процесс, обратный дыханию: 2Na 2 O 2 + 2CO 2 → 2Na 2 CO 3 + O 2 , т. е. углекислый газ связывается, а кислород выделяется. Совсем как в зеленом листе!
- НАТРИЙ И ЗОЛОТО. К тому времени, как был открыт №11, алхимия была уже не в чести, и мысль превращать натрий в золото не будоражила умы естествоиспытателей. Однако сейчас ради получения золота расходуется очень много натрия. «Руду золотую» обрабатывают раствором цианистого натрия (а его получают из элементного натрия). При этом золото превращается в растворимое комплексное соединение, из которого его выделяют с помощью цинка. Золотодобытчики - среди основных потребителей элемента № 11. В промышленных масштабах цианистый Na получают при взаимодействии натрия, аммиака и кокса при температуре около 800°С.
- НАТРИЕВЫЕ ПРОВОДА. Электропроводность натрия в три раза ниже, чем электропроводность меди . Но натрий в 9 раз легче! Выходит, что натриевые провода выгоднее медных. Конечно, тонкие провода из натрия не делают, но вот шины для больших токов целесообразно изготовлять именно из натрия. Эти шины представляют собой заваренные с торцов стальные трубы, внутри заполненные натрием. Такие шины дешевле медных.
- НАТРИЙ В ВОДЕ. Каждый школьник знает, что произойдет, если бросить кусочек натрия в воду. Точнее, не в воду, а на воду, потому что натрий легче воды. Тепла, которое выделяется при реакции натрия с водой, достаточно, чтобы расплавить натрий. И вот бегает по воде натриевый шарик, подгоняемый выделяющимся водородом . Однако реакция натрия с водой - не только опасная забава; напротив она часто бывает полезной. Натрием надежно очищают от следов воды трансформаторные масла, спирты, эфиры и другие органические вещества, а с помощью амальгамы натрия (т. е. сплава натрия с ртутью) можно быстро определить содержание влаги во многих соединениях. Амальгама реагирует с водой намного спокойнее, чем сам натрий. Для определения влажности к пробе органического вещества добавляют определенное количество амальгамы натрия и по объему выделившегося водорода судят о содержании влаги.
- НАТРИЕВЫЙ ПОЯС ЗЕМЛИ. Вполне естественно, что на Земле Na никогда не встречается в свободном состоянии - слишком активен этот металл. Но в верхних слоях атмосферы - на высоте около 80 км - обнаружен слой атомарного натрия. На такой высоте практически нет кислорода, паров воды и вообще ничего, с чем натрий мог бы вступить в реакцию. Спектральными методами натрий был обнаружен и в межзвездном пространстве.
- ИЗОТОПЫ НАТРИЯ. Природный натрий состоит только из одного изотопа с массовым числом 23. Известны 13 радиоактивных изотопов этого элемента, причем два из них представляют значительный интерес для науки. Натрий-22, распадаясь, излучает позитроны - положительно заряженные частицы, масса которых равна массе электронов. Этот изотоп с периодом полураспада 2,58 года используют в качестве позитронного источника. А изотоп натрий-24 (его период полураспада около 15 часов) применяют в медицине для диагностики и для лечения некоторых форм лейкемии - тяжелого заболевания крови.
Как получают натрий
Современный электролизер для получения натрия - довольно внушительное сооружение, внешне напоминающее печь. Эта «печка» сложена из огнеупорного кирпича и снаружи окружена стальным кожухом. Снизу через дно электролизера введен графитовый анод, окруженный кольцеобразной сеткой - диафрагмой. Эта сетка не дает возможности натрию проникнуть в анодное пространство, где выделяется хлор . Иначе элемент №11 сгорел бы в хлоре. Анод, кстати, тоже кольцеобразный. Он сделан из стали. Обязательная принадлежность электролизера - два колпака. Один устанавливают над анодом для сбора хлора, другой - над катодом для отвода натрия.
В электролизере загружают смесь тщательно высушенных хлористого натрия и хлористого кальция. Такая смесь плавится при более низкой температуре, чем чистый хлористый натрий. Обычно электролиз ведут при температуре около 600°С.
На электроды подают постоянный ток напряжением около 6 в; на катоде происходит разряд ионов Na + и выделение металлического натрия. Натрий всплывает и отводится в специальный сборник (разумеется, без доступа воздуха). На аноде разряжаются ноны хлора Cl - и выделяется газообразный хлор - ценный побочный продукт натриевого производства.
Обычно электролизер работает под нагрузкой 25 - 30 тыс. А, при этом в сутки производится 400 - 500 кг натрия и 600 - 700 кг хлора.
«САМЫЙ МЕТАЛЛИЧЕСКИЙ МЕТАЛЛ». Так иногда называют натрий. Это не совсем справедливо: в менделеевской таблице нарастание металлических свойств происходит по мере продвижения справа налево и сверху вниз. Так что у аналогов натрия по группе - франция , рубидия , цезия , калия - металлические свойства выражены сильнее, чем у натрия. (Конечно, имеются в виду только химические свойства.) Но и у натрия есть полный комплекс «металлических» химических свойств. Он легко отдает свои валентные электроны (по одному на атом), всегда проявляет валентность 1+ , обладает ярко выраженными восстановительными свойствами. Гидроокись натрия NaOH - сильная щелочь. Все это объясняется строением атома натрия, на внешней оболочке которого один электрон, и с ним атом легко расстается.
Содержание статьи
НАТРИЙ – (Natrium) Na, химический элемент 1-й (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 11, относительная атомная масса 22,98977. В природе имеется один стабильный изотоп 23 Na. Известны шесть радиоактивных изотопов этого элемента, причем два из них представляют интерес для науки и медицины. Натрий-22 с периодом полураспада 2,58 года используют в качестве источника позитронов. Натрий-24 (его период полураспада около 15 часов) применяют в медицине для диагностики и для лечения некоторых форм лейкемии.
Степень окисления +1.
Соединения натрия известны с древних времен. Хлорид натрия – необходимейший компонент человеческой пищи. Cчитается, что человек начал употреблять его в неолите, т.е. около 5–7 тыс. лет назад.
В Ветхом завете упоминается некое вещество «нетер». Это вещество использовалось как моющее средство. Скорее всего, нетер – это сода, карбонат натрия, который образовывался в соленых египетских озерах с известковыми берегами. Об этом же веществе, но под названием «нитрон» писали позже греческие авторы Аристотель и Диоскорид, а древнеримский историк Плиний Старший, упоминая это же вещество, называл его уже «нитрум».
В 18 в. химикам было известно уже очень много различных соединений натрия. Соли натрия широко применялись в медицине, при выделке кож, при крашении тканей.
Металлический натрий получил впервые английский химик и физик Гемфри Дэви электролизом расплавленного гидроксида натрия (с использованием вольтова столба из 250 пар медных и цинковых пластин). Название «sodium», выбранное Дэви для этого элемента, отражает его происхождение из соды Na 2 CO 3 . Латинское и русское названия элемента произведены от арабского «натрун» (природная сода).
Распространение натрия в природе и его промышленное извлечение.
Натрий – седьмой из наиболее распространенных элементов и пятый из наиболее распространенных металлов (после алюминия, железа, кальция и магния). Его содержание в земной коре составляет 2,27%. Большая часть натрия находится в составе различных алюмосиликатов.
Огромные отложения солей натрия в сравнительно чистом виде существуют на всех континентах. Они являются результатом испарения древних морей. Этот процесс по-прежнему продолжается в озере Солт-Лейк (штат Юта), Мертвом море и других местах. Натрий встречается в виде хлорида NaCl (галит, каменная соль), а также карбоната Na 2 CO 3 ·NaHCO 3 ·2H 2 O (трона), нитрата NaNO 3 (селитра), сульфата Na 2 SO 4 ·10H 2 O (мирабилит), тетрабората Na 2 B 4 O 7 ·10 H 2 O (бура) и Na 2 B 4 O 7 ·4H 2 O (кернит) и других солей.
Неиссякаемые запасы хлорида натрия есть в природных рассолах и океанических водах (около 30 кг м –3). Подсчитано, что каменная соль в количестве, эквивалентном содержанию хлорида натрия в Мировом океане, занимала бы объем 19 млн. куб. км (на 50% больше, чем общий объем Североамериканского континента выше уровня моря). Призма такого объема с площадью основания 1 кв. км может достичь Луны 47 раз.
Сейчас суммарное производство хлорида натрия из морской воды достигло 6–7 млн. т в год, что составляет около трети общей мировой добычи.
В живом веществе в среднем содержится 0,02% натрия; в животных его больше, чем в растениях.
Характеристика простого вещества и промышленное получение металлического натрия.
Натрий – серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см 3 (при 19,7° С), температура плавления 97,86° С, температура кипения 883,15° С.
У тройного сплава, содержащего 12% натрия, 47% калия и 41% цезия, – самая низкая температура плавления для металлических систем, равная –78° С.
Натрий и его соединения окрашивают пламя в ярко-желтый цвет. Двойная линия в спектре натрия отвечает переходу 3s 1–3p 1 в атомах элемента.
Химическая активность натрия высока. На воздухе он быстро покрывается пленкой из смеси пероксида, гидроксида и карбоната. В кислороде, фторе и хлоре натрий горит. При сжигании металла на воздухе образуется пероксид Na 2 O 2 (с примесью оксида Na 2 O).
С серой натрий реагирует уже при растирании в ступке, серную кислоту восстанавливает до серы или даже до сульфида. Твердый диоксид углерода («сухой лед») при контакте с натрием взрывается (углекислотные огнетушители для тушения горящего натрия применять нельзя!). С азотом реакция идет только в электрическом разряде. Не взаимодействует натрий лишь с инертными газами.
Натрий активно реагирует с водой:
2Na + 2H 2 O = 2NaOH + H 2
Тепла, которое выделяется при реакции, достаточно, чтобы расплавить металл. Поэтому, если маленький кусочек натрия бросить в воду, он за счет теплового эффекта реакции плавится и капелька металла, который легче воды, «бегает» по поверхности воды, подгоняемая реактивной силой выделяющегося водорода. Со спиртами натрий взаимодействует намного спокойнее, чем с водой:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2
Натрий легко растворяется в жидком аммиаке с образованием ярко-голубых метастабильных растворов с необычными свойствами. При –33,8° С в 1000 г аммиака растворяется до 246 г металлического натрия. Разбавленные растворы имеют синий цвет, концентрированные – цвет бронзы. Они могут храниться около недели. Установлено, что в среде жидкого аммиака натрий ионизуется:
Na Na + + e –
Константа равновесия этой реакции равна 9,9·10 –3 . Уходящий электрон сольватируется молекулами аммиака и образует комплекс – . Полученные растворы обладают металлической электропроводностью. При испарении аммиака остается исходный металл. При длительном хранении раствора он постепенно обесцвечивается за счет реакции металла с аммиаком с образованием амида NaNH 2 или имида Na 2 NH и выделением водорода.
Хранят натрий под слоем обезвоженной жидкости (керосин, минеральное масло), перевозят только в запаянных металлических сосудах.
Электролитический способ промышленного получения натрия был разработан в 1890. Электролизу подвергали расплав едкого натра, как в опытах Дэви, но с использованием более совершенных источников энергии, чем вольтов столб. В этом процессе наряду с натрием выделяется кислород:
анод (никелевый): 4OH – – 4e – = O 2 + 2H 2 O.
При электролизе чистого хлорида натрия возникают серьезные проблемы, связанные, во-первых, с близкими температурой плавления хлорида натрия и температурой кипения натрия и, во-вторых, с высокой растворимостью натрия в жидком хлориде натрия. Добавление к хлориду натрия хлорида калия, фторида натрия, хлорида кальция позволяет снизить температуру расплава до 600° С. Производство натрия электролизом расплавленной эвтектической смеси (сплав двух веществ с самой низкой температурой плавления) 40% NaCl и 60% CaCl 2 при ~580° С в ячейке, разработанной американским инженером Г.Даунсом, было начато в 1921 Дюпоном вблизи электростанции у Ниагарского водопада.
На электродах протекают следующие процессы:
катод (железный): Na + + e – = Na
Ca 2+ + 2e – = Ca
анод (графитовый): 2Cl – – 2e – = Cl 2 .
Металлические натрий и кальций образуются на цилиндрическом стальном катоде и поднимаются с помощью охлаждаемой трубки, в которой кальций затвердевает и падает обратно в расплав. Хлор, образующийся на центральном графитовом аноде, собирается под никелевым сводом и затем очищается.
Сейчас объем производства металлического натрия составляет несколько тысяч тонн в год.
Промышленное использование металлического натрия связано с его сильными восстановительными свойствами. Долгое время большая часть производимого металла использовалась для получения тетраэтилсвинца PbEt 4 и тетраметилсвинца PbMe 4 (антидетонаторов для бензина) реакцией алкилхлоридов со сплавом натрия и свинца при высоком давлении. Сейчас это производство быстро сокращается из-за загрязнения окружающей среды.
Еще одна область применения – производство титана, циркония и других металлов восстановлением их хлоридов. Меньшие количества натрия используются для получения соединений, таких как гидрид, пероксид и алкоголяты.
Диспергированный натрий является ценным катализатором при производстве резины и эластомеров.
Растет применение расплавленного натрия в качестве теплообменной жидкости в ядерных реакторах на быстрых нейтронах. Низкая температура плавления натрия, низкая вязкость, малое сечение поглощения нейтронов в сочетании с чрезвычайно высокой теплоемкостью и теплопроводностью делает его (и его сплавы с калием) незаменимым материалом для этих целей.
Натрием надежно очищают трансформаторные масла, эфиры и другие органические вещества от следов воды, а с помощью амальгамы натрия можно быстро определить содержание влаги во многих соединениях.
Соединения натрия.
Натрий образует полный набор соединений со всеми обычными анионами. Считается, что в таких соединениях происходит практически полное разделение заряда между катионной и анионной частями кристаллической решетки.
Оксид натрия Na 2 O синтезируют реакцией Na 2 O 2 , NaOH, а предпочтительнее всего NaNO 2 , с металлическим натрием:
Na 2 O 2 + 2Na = 2Na 2 O
2NaOH + 2Na = 2Na 2 O + H 2
2NaNO 2 + 6Na = 4Na 2 O + N 2
В последней реакции натрий можно заменить азидом натрия NaN 3:
5NaN 3 + NaNO 2 = 3Na 2 O + 8N 2
Хранить оксид натрия лучше всего в безводном бензине. Он служит реактивом для различных синтезов.
Пероксид натрия Na 2 O 2 в виде бледно-желтого порошка образуется при окислении натрия. При этом в условиях ограниченной подачи сухого кислорода (воздуха) сначала образуется оксид Na 2 O, который затем превращается в пероксид Na 2 O 2 . В отсутствие кислорода пероксид натрия термически устойчив до ~675° C.
Пероксид натрия широко используется в промышленности как отбеливатель для волокон, бумажной пульпы, шерсти и т.д. Он является сильным окислителем: взрывается в смеси с порошком алюминия или древесным углем, реагирует с серой (при этом раскаляется), воспламеняет многие органические жидкости. Пероксид натрия при взаимодействии с монооксидом углерода образует карбонат. В реакции пероксида натрия с диоксидом углерода выделяется кислород:
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2
Эта реакция имеет важное практическое применение в дыхательных аппаратах для подводников и пожарных.
Надпероксид натрия NaO 2 получают при медленном нагревании пероксида натрия при 200–450° С под давлением кислорода 10–15 МПа. Доказательства образования NaO 2 были впервые получены в реакции кислорода с натрием, растворенным в жидком аммиаке.
Действие воды на надпероксид натрия приводит к выделению кислорода даже на холоду:
2NaO 2 + H 2 O = NaOH + NaHO 2 + O 2
При повышении температуры количество выделяющегося кислорода увеличивается, так как происходит разложение образующегося гидропероксида натрия:
4NaO 2 + 2H 2 O = 4NaOH + 3O 2
Надпероксид натрия является компонентом систем для регенерации воздуха в замкнутых помещениях.
Озонид натрия NaО 3 образуется при действии озона на безводный порошок гидроксида натрия при низкой температуре с последующей экстракцией красного NaО 3 жидким аммиаком.
Гидроксид натрия NaOH нередко называют каустической содой или едким натром. Это сильное основание, его относят к типичным щелочам. Из водных растворов гидроксида натрия получены многочисленные гидраты NaOH·n H 2 O, где n = 1, 2, 2,5, 3,5, 4, 5,25 и 7.
Гидроксид натрия очень агрессивен. Он разрушает стекло и фарфор за счет взаимодействия с содержащимся в них диоксидом кремния:
2NaOH + SiO 2 = Na 2 SiO 3 + H 2 O
Название «едкий натр» отражает разъедающее действие гидроксида натрия на живые ткани. Особенно опасно попадание этого вещества в глаза.
Врач герцога Орлеанского Никола Леблан (Leblanc Nicolas) (1742–1806) в 1787 разработал удобный процесс получения гидроксида натрия из NaCl (патент 1791). Этот первый крупномасштабный промышленный химический процесс стал крупным технологическим достижением в Европе в 19 в. Позднее процесс Леблана был вытеснен электролитическим процессом. В 1874 мировое производство гидроксида натрия составило 525 тыс. т, из которых 495 тыс. т были получены по способу Леблана; к 1902 производство гидроксида натрия достигло 1800 тыс. т., ооднако по способу Леблана были получены только 150 тыс. т.
Сегодня гидроксид натрия – наиболее важная щелочь в промышленности. Ежегодное производство только в США превышает 10 млн. т. Ее получают в огромных количествах электролизом рассолов. При электролизе раствора хлорида натрия образуется гидроксид натрия и выделяется хлор:
катод (железный) 2H 2 O + 2e – = H 2 + 2OH –
анод (графитовый) 2Cl – – 2e – = Cl 2
Электролиз сопровождается концентрированием щелочи в огромных выпаривателях. Самый большой в мире (на заводе PPG Inductries" Lake Charles) имеет высоту 41 м и диаметр 12 м. Около половины производимого гидроксида натрия используется непосредственно в химической промышленности для получения различных органических и неорганических веществ: фенола, резорцина, b -нафтола, солей натрия (гипохлорита, фосфата, сульфида, алюминатов). Кроме того, гидроксид натрия применяется в производстве бумаги и пульпы, мыла и моющих средств, масел, текстиля. Он необходим и при переработке бокситов. Важной областью применения гидроксида натрия является нейтрализация кислот.
Хлорид натрия NaCl известен под названиями поваренной соли, каменной соли. Он образует бесцветные мало гигроскопичные кристаллы кубической формы. Хлорид натрия плавится при 801° С, кипит при 1413° С. Его растворимость в воде мало зависит от температуры: в 100 г воды при 20° С растворяется 35,87 г NaCl, а при 80° С – 38,12 г.
Хлорид натрия – необходимая и незаменимая приправа к пище. В далеком прошлом соль приравнивалась по цене к золоту. В древнем Риме легионерам часто платили жалование не деньгами, а солью, отсюда и произошло слово солдат.
В Киевской Руси пользовались солью из Прикарпатья, из соляных озер и лиманов на Черном и Азовском морях. Она обходилась настолько дорого, что на торжественных пирах ее подавали на столы знатных гостей, прочие же расходились «несолоно хлебавши».
После присоединения Астраханского края к Московскому государству важными источниками соли стали озера Прикаспия, и все равно ее не хватало, она была дорога, поэтому возникало недовольство самых бедных слоев населения, которое переросло в восстание, известное под названием Соляного Бунта (1648)
В 1711 Петр I издал указ о введении соляной монополии. Торговля солью стала исключительным правом государства. Соляная монополия просуществовала более полутораста лет и была отменена в 1862.
Ныне хлорид натрия – дешевый продукт. Вместе с каменным углем, известняком и серой он входит в так называемую «большую четверку» минерального сырья, наиболее существенного для химической промышленности.
Большая часть хлорида натрия производится в Европе (39%), Северной Америке (34%) и Азии (20%), в то время как на Южную Америку и Океанию приходится лишь по 3%, а на Африку – 1%. Каменная соль образует обширные подземные месторождения (нередко в сотни метров толщиной), которые содержат более 90% NaCl. Типичное Чеширское соляное месторождение (главный источник хлорида натрия в Великобритании) занимает площадь 60 ґ 24 км и имеет толщину соляного пласта около 400 м. Одно это месторождение оценивается более чем в 10 11 т.
Мировой объем добычи соли к началу 21 в. достиг 200 млн. т, 60% которой потребляет химическая промышленность (для производства хлора и гидроксида натрия, а также бумажной пульпы, текстиля, металлов, резин и масел), 30% – пищевая, 10% приходится на прочие сферы деятельности. Хлорид натрия используется, например, в качестве дешевого антигололедного реагента.
Карбонат натрия Na 2 CO 3 часто называют кальцинированной содой или просто содой. Он встречается в природе в виде грунтовых рассолов, рапы в озерах и минералов натрона Na 2 CO 3 ·10H 2 O, термонатрита Na 2 CO 3 ·H 2 O, троны Na 2 CO 3 ·NaHCO 3 ·2H 2 O. Натрий образует и другие разнообразные гидратированные карбонаты, гидрокарбонаты, смешанные и двойные карбонаты, например Na 2 CO 3 ·7H 2 O, Na 2 CO 3 ·3NaHCO 3 , aKCO 3 ·n H 2 O, K 2 CO 3 ·NaHCO 3 ·2H 2 O.
Среди солей щелочных элементов, получаемых в промышленности, карбонат натрия имеет наибольшее значение. Чаще всего для его производства используют метод, разработанный бельгийским химиком-технологом Эрнстом Сольве в 1863.
Концентрированный водный раствор хлорида натрия и аммиака насыщают диоксидом углерода под небольшим давлением. При этом образуется осадок сравнительно малорастворимого гидрокарбоната натрия (растворимость NaHCO 3 составляет 9,6 г на 100 г воды при 20° С):
NaCl + NH 3 + H 2 O + CO 2 = NaHCO 3 Ї + NH 4 Cl
Для получения соды гидрокарбонат натрия прокаливают:
Выделяющийся диоксид углерода возвращают в первый процесс. Дополнительное количество диоксида углерода получают за счет прокаливания карбоната кальция (известняка):
Второй продукт этой реакции – оксид кальция (известь) – используют для регенерации аммиака из хлорида аммония:
Таким образом, единственным побочным продуктом производства соды по методу Сольве является хлорид кальция.
Суммарное уравнение процесса:
2NaCl + CaCO 3 = Na 2 CO 3 + CaCl 2
Очевидно, в обычных условиях в водном растворе идет обратная реакция, поскольку равновесие в этой системе нацело смещено справа налево из-за нерастворимости карбоната кальция.
Кальцинированная сода, полученная из природного сырья (натуральная кальцинированная сода), имеет лучшее качество по сравнению с содой, полученной аммиачным способом (содержание хлоридов менее 0,2%). Кроме того, удельные капитальные вложения и себестоимость соды из природного сырья на 40–45% ниже, чем полученной синтетическим путем. Около трети мировой продукции соды приходится сейчас на природные месторождения.
Мировое производство Na 2 CO 3 в 1999 распределилось следующим образом:
| Всего | |
| Сев. Америка | |
| Азия/Океания | |
| Зап. Европа | |
| Вост. Европа | |
| Африка | |
| Лат. Америка |
Крупнейший в мире производитель натуральной кальцинированной соды – США, где сосредоточены и самые большие разведанные запасы троны и рапы содовых озер. Месторождение в Вайоминге образует слой толщиной 3 м и площадью 2300 км 2 . Его запасы превышают 10 10 т. В США содовая промышленность ориентирована на природное сырье; последнее предприятие по синтезу соды было закрыто в 1985. Выработка кальцинированной соды в США в последние годы стабилизировалась на уровне 10,3–10,7 млн. т.
В отличие от США, большинство стран мира практически полностью зависят от производства синтетической кальцинированной соды. Второе место в мире по производству кальцинированной соды после США занимает Китай. Выработка этого химиката в КНР в 1999 достигла примерно 7,2 млн. т. Производство кальцинированной соды в России в том же году составило порядка 1,9 млн. т.
Во многих случаях карбонат натрия взаимозаменяем с гидроксидом натрия (например, при получении бумажной пульпы, мыла, чистящих средств). Около половины карбоната натрия используется в стекольной промышленности. Одна из развивающихся областей применения – удаление сернистых загрязнений в газовых выбросах предприятий энергетики и мощных печей. В топливо добавляют порошок карбоната натрия, который реагирует с диоксидом серы с образованием твердых продуктов, в частности сульфита натрия, которые могут быть отфильтрованы или осаждены.
Ранее карбонат натрия широко применялся в качестве «стиральной соды», но эта область применения теперь исчезла из-за использования в быту других моющих средств.
Гидрокарбонат натрия NaHCO 3 (пищевая сода), применяется, главным образом, как источник диоксида углерода при выпечке хлеба, изготовлении кондитерских изделий, производстве газированных напитков и искусственных минеральных вод, как компонент огнетушащих составов и лекарственное средство. Это связано с легкостью его разложения при 50–100° С.
Сульфат натрия Na 2 SO 4 встречается в природе в безводном виде (тенардит) и в виде декагидрата (мирабилит, глауберова соль). Он входит в состав астрахонита Na 2 Mg(SO 4) 2 ·4H 2 O, вантгоффита Na 2 Mg(SO 4) 2 , глауберита Na 2 Ca(SO 4) 2 . Наиболее крупные запасы сульфата натрия – в странах СНГ, а также в США, Чили, Испании. Мирабилит, выделенный из природных залежей или рапы соляных озер, обезвоживают при 100° С. Сульфат натрия является также побочным продукт производства хлороводорода с использованием серной кислоты, а также конечным продуктом сотен промышленных производств, в которых применяется нейтрализация серной кислоты с помощью гидроксида натрия.
Данные о добыче сульфата натрия не публикуются, но, по оценке, мировое производство природного сырья составляет около 4 млн. т в год. Извлечение сульфата натрия в качестве побочного продукта оценивается в мире в целом в 1,5–2,0 млн. т.
Долгое время сульфат натрия мало использовался. Теперь это вещество – основа бумажной промышленности, так как Na 2 SO 4 является главным реагентом в сульфатной варке целлюлозы для приготовления коричневой оберточной бумаги и гофрированного картона. Древесные стружки или опилки переорабатывается в горячем щелочном растворе сульфата натрия. Он растворяет лигнин (компонент древесины, соединяющий волокна) и освобождает волокна целлюлозы, которые затем отправляют на машины для изготовления бумаги. Оставшийся раствор выпаривают, пока он не приобретет способность гореть, давая пар для завода и тепло для выпаривания. Расплавленные сульфат и гидроксид натрия устойчивы к действию пламени и могут быть использованы повторно.
Меньшая часть сульфата натрия применяется при производстве стекла и моющих средств. Гидратированная форма Na 2 SO 4 ·10H 2 O (глауберова соль) является слабительным средством. Сейчас она используется меньше, чем раньше.
Нитрат натрия NaNO 3 называют натриевой или чилийской селитрой. Большие залежи нитрата натрия, найденные в Чили, по-видимому, образовались за счет биохимического разложения органических остатков. Выделившийся вначале аммиак, вероятно, окислился до азотистой и азотной кислот, которые затем прореагировали с растворенным хлоридом натрия.
Получают нитрат натрия поглощением нитрозных газов (смесь оксидов азота) раствором карбоната или гидроксида натрия либо обменным взаимодействием нитрата кальция с сульфатом натрия.
Нитрат натрия применяют как удобрение. Он является компонентом жидких солевых хладагентов, закалочных ванн в металлообрабатывающей промышленности, теплоаккумулирующих составов. Тройная смесь из 40% NaNO 2 , 7% NaNO 3 и 53% KNO 3 может использоваться от температуры плавления (142° С) до ~600° С. Нитрат натрия используется как окислитель во взрывчатых веществах, ракетных топливах, пиротехнических составах. Он применяется в производстве стекла и солей натрия, в том числе нитрита, служащего консервантом пищевых продуктов.
Нитрит натрия NaNO 2 может быть получен термическим разложением нитрата натрия или его восстановлением:
NaNO 3 + Pb = NaNO 2 + PbO
Для промышленного производства нитрита натрия абсорбируют оксиды азота водным раствором карбоната натрия.
Нитрит натрия NaNO 2 , кроме использования с нитратами в качестве теплопроводных расплавов, широко применяется в производстве азокрасителей, для ингибирования коррозии и консервации мяса.
Елена Савинкина