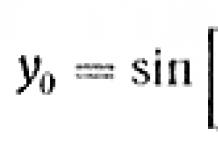Урок по химии в 11 классе: «Дисперсные системы и растворы»
Цель - дать понятие о дисперсных системах, их классификация. Раскрыть значение коллоидных систем в жизни природы и общества. Показать относительность деления растворов на истинные и коллоидные.
Оборудование и материалы:
Технологические карты: схема-таблица, лабораторная работа, инструкции.
Оборудование для лабораторных работ:
Реактивы: раствор сахара, раствор хлорида железа (III), смесь воды и речного песка, желатин, клейстер, нефть, раствор хлорида алюминия, раствор поваренной соли, смесь воды и растительного масла.
Химические стаканы
Бумажные фильтры.
Черная бумага.
Фонарики
Ход урока по химии в 11 классе:
| Этап урока | Особенности этапа | Действия учителя | Действия учеников |
| Организационный (2 мин.) | Подготовка к уроку | Приветствует учеников. |
Готовятся к уроку. Здороваются с учителем. |
| Введение (5 мин.) | Введение в новую тему. |
Подводит к теме урока, задачам и «вопросам для себя» Знакомит с темой урока. Выводит на экран задачи сегодняшнего урока. |
Принимают участие в обсуждении темы. Знакомятся с темой урока и задачами (ПРИЛОЖЕНИЕ №1) Записывают три вопроса по теме, на которые хотели бы получить ответы. |
|
Теоретическая часть (15 мин.) |
Объяснение новой темы. | Дает задания для работы в группах по поиску нового материала (ПРИЛОЖЕНИЕ №3,4) | Объединившись в группы, выполняют задания сообразуясь с технологической картой, предоставленной схемой (ПРИЛОЖЕНИЕ №4) и требованиями учителя. |
| Подведение итогов по теоретической части (8 мин.) | Выводы на основе полученных теоретических знаний. |
Заранее вывешивает на доске пустые схемы (формат А3) для наглядного заполнения учениками. (ПРИЛОЖЕНИЕ №4) Совместно с учениками формулирует основные теоретические выводы. |
Маркером заполняют схемы, соответствующие той, по которой работали, отчитываются по проведенной работе в группах Записывают в технологических картах основные выводы. |
| Практическая часть (10 мин.) | Выполнение лабораторной работы, закрепление полученного опыта. | Предлагает выполнить лабораторную работу по теме «Дисперсные системы» (ПРИЛОЖЕНИЕ №2) | Выполняют лабораторную работу (ПРИЛОЖЕНИЕ №2), заполняют бланки, сообразуясь с инструкцией к лабораторной работе и требованиями учителя. |
|
Обобщение и выводы (5 мин.) |
Подведение итогов урока. Домашнее задание. |
Вместе с учениками делает вывод относительно темы. Предлагает соотнести вопросы, которые были написаны в начале урока с тем, что получили в конце урока. |
Подводят итоги, записывают домашнее задание. |
Формы и методы контроля:
Технологические схемы для заполнения (ПРИЛОЖЕНИЕ №4).
Лабораторная работа (ПРИЛОЖЕНИЕ №2)
Контроль осуществляется фронтально в устной и письменной форме. По итогам выполнения лабораторной работы карты с лабораторными работами сдаются учителю на проверку.
1. Введение:
Ответьте, чем отличаются мрамор и гранит? А минеральная и дистиллированная вода?
(ответ: мрамор - чистое вещество, гранит - смесь веществ, дистиллированная вода - чистое вещество, минеральная вода - смесь веществ).
Хорошо. А молоко? Это чистое вещество или смесь? А воздух?
Состояние любого чистого вещества описывается очень просто - твердое, жидкое, газообразное.
Но ведь абсолютно чистых веществ в природе не существует. Даже незначительное количество примесей может существенно влиять на свойство веществ: температуру кипения, электро- и теплопроводимость, реакционную способность и т.д.
Получение абсолютно чистых веществ - одна из важнейших задач современной химии, ведь именно чистота вещества определяет возможность проявления им своих индивидуальных средств (демонстрация реактивов с маркировкой).
Следовательно, в природе и практической жизни человека встречаются не отдельные вещества, а их системы.
Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Гомогенными системами являются растворы, с которыми мы ознакомились на прошлом уроке.
Сегодня мы познакомимся с гетерогенными системами.
2. Тема сегодняшнего урока - ДИСПЕРСНЫЕ СИСТЕМЫ.
Изучив тему урока, вы узнаете:
значение дисперсных систем.
Это, как вы понимаете, наши основные задачи. Они прописаны в ваших технологических картах. Но чтобы наша работа была более продуктивной и мотивированной, я предлагаю вам рядом с основными задачами написать не менее трех вопросов, на которые вы бы хотели найти ответ в процессе данного урока.
3. Теоретическая часть.
Дисперсные системы - что это?
Попробуем вместе вывести определение, исходя из построения слов.
1) Систе́ма (от др.-греч. «система» — целое, составленное из частей; соединение) — множество элементов, находящихся в отношениях и связях друг с другом, которое образует определённую целостность, единство.
2) Дисперсия - (от лат. dispersio — рассеяние) разброс чего-либо, дробление.
Дисперсные системы - гетерогенные (неоднородные) системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого.

Если мы опять обратимся к повторению и предыдущему уроку, мы сможем вспомнить, что: растворы состоят из двух компонентов: растворимое вещество и растворитель.
Дисперсные системы, как смеси веществ, имеют аналогичное строение: состоят из мелких частиц, которые равномерно распределены в объеме другого вещества.
Взгляните в свои технологические карты, и попробуйте из разрозненных частей составить две аналогичные схемы: для раствора и для дисперсной системы.
Проверим получившиеся результаты, сверив их с изображением на экране.
Итак, дисперсионная среда в дисперсной системе выполняет роль растворителя, и является т.н. непрерывной фазой, а дисперсная фаза - роль растворенного вещества.
Так как дисперсионная система - гетерогенная смесь, то между дисперсной средой и дисперсионной фазой есть поверхность раздела.
Классификация дисперсных систем.
Можно изучать каждую дисперсную систему по отдельности, но лучше их классифицировать, выделить общее, типичное и это запомнить. Для этого нужно определить, по каким признакам это сделать. Вы объединены в группы, каждой из которых дано задание и прилагающаяся к нему блок-схема.
Руководствуясь предложенной вам литературой, найдите в тексте, предложенный Вам для изучения признак классификации, изучите его.
Создайте кластер (блок-схема), указав признаки и свойства дисперсных систем, приведите к нему примеры. Для помощи в этом вам уже предоставлена пустая блок-схема, которую вам предстоит заполнить.
4. Вывод по теоретическому заданию.
Давайте подведем итоги.
От каждой команды прошу выйти по одному человеку и заполнить схемы, вывешенные на доске.
(ученики подходят и маркером заполняют каждую из схем, после чего отчитыватся по проведенной работе)
Молодцы, теперь давайте закрепим:
Что является основой для классификации дисперсных систем?
На какие виды делятся дисперсные системы?
Какие особенности коллоидных растворов вы знаете?
Как иначе называются гели? Какое значение они имеют? В чем их особенность?
5. Практическая часть.
Теперь, когда вы знакомы с особенностями дисперсных систем и их классификацией, а также определили по какому принципу классифицируются дисперсные системы, предлагаю вам закрепить это знание на практике, выполнив соответствующую лабораторную работу, предложенную вам на отдельном бланке.
Вы объединены в группы по 2 человека. На каждую группу у вас приложен соответствующий бланк с лабораторной работой, а также определенный набор реактивов, которые вам нужно изучить.
Вам выдан образец дисперсной системы.
Ваша задача: пользуясь инструкцией, определить, какая дисперсная система вам выдана, заполнить таблицу и сделать вывод об особенностях дисперсионной системы.
6. Обобщение и выводы.
Итак, на данном уроке мы с вами изучили более углубленно классификацию дисперсных систем, важность их в природе и жизни человека.
Однако следует отметить, что резкой границы между видами дисперсных систем нет. Классификацию следует считать относительной.
А теперь вернемся к поставленным на сегодняшний урок задачам:
что такое дисперсные системы?
какими бывают дисперсные системы?
какими свойствами обладают дисперсные системы?
значение дисперсных систем.
Обратите внимание на вопросы, которые вы записали для себя. В рамке рефлексии отметьте полезность данного урока.
7. Домашнее задание.
Мы постоянно сталкиваемся с дисперсными системами в природе и быту, даже в нашем организме существуют дисперсные системы. Для того, чтобы закрепить знания о значимости дисперсных систем, вам предлагается выполнить домашнее задание в форме эссе/
Выберите дисперсную систему, с которой вы постоянно сталкиваетесь в своей жизни. Напишите эссе на 1-2 страницы: «Какое значение имеет данная дисперсная система в жизни человека? Какие похожие дисперсные системы с похожими функциями еще известны?»
Спасибо за урок.
Классификация дисперсных систем может быть проведена на основе различных свойств: по дисперсности, по агрегатному состоянию фаз, по взаимодействию дисперсной фазы и дисперсной среды, по межчастичному взаимодействию.
Классификация по дисперсности
Зависимость величины удельной поверхности от дисперсности S уд = f(d) графически выражается равносторонней гиперболой (рис.).Из графика видно, что с уменьшением поперечных размеров частиц величина удельной поверхности существенно возрастает. Если кубик с размером ребра 1 см измельчить до кубических частиц с размерами d = 10 -6 см, величина общей межфазной поверхности возрастет с 6 см 2 до 600 м 2 .
При d ≤ 10 -7 см гипербола обрывается, так как частицы уменьшаются до размеров отдельных молекул, и гетерогенная система становится гомогенной, в которой межфазная поверхность отсутствует. По степени дисперсности дисперсные системы делятся на:
- грубодисперсные системы, d ≥ 10 -3 см;
- микрогетерогенные системы, 10 -5 ≤ d ≤ 10 -3 см;
- коллоидно-дисперсные системы или коллоидные растворы, 10 -7 ≤ d ≤ 10 -5 см;
- истинные растворы, d ≤ 10 -7 см.
Классификация по агрегатному состоянию фаз
Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом. В принципе возможно 9 комбинаций. Представим их в виде таблицы.| Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсной среды | Условное обозначения | Название системы | Примеры |
| г | г | г/г | аэрозоли | атмосфера Земли |
| ж | г | ж/г | туман, слоистые облака | |
| тв | г | тв/г | дымы, пыли, перистые облака | |
| г | ж | г/ж | газовые эмульсии, пены | газированная вода, мыльная пена, лечебный кислородный коктейль, пивная пена |
| ж | ж | ж/ж | эмульсии | молоко, масло сливочное, маргарин, кремы и т. д. |
| тв | ж | тв/ж | лиозоли, суспензии | лиофобные коллоидные растворы, суспензии, пасты, краски ит. д. |
| г | тв | г/тв | твердые пены | пемза, твердые пены, пенопласт, пенобетон, хлеб, пористые тела в газе ит. д. |
| ж | тв | ж/тв | твердые эмульсии | вода в парафине, природпые минералы с жидкими включениями, пористые тела в жидкости |
| тв | тв | тв/тв | твердые золи | сталь, чугун, цветные стекла, драгоценные камни: золь Аи в стекле — рубиновое стекло (0,0001%) (1т стекла — 1г Au) |
Классификация по взаимодействию дисперсной фазы и дисперсной среды (по межфазному взаимодействию).
Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить дисперсных систем на два вида:- лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы;
- лиофильные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС.
Классификация по межчастичному взаимодействию
Согласно этой классификации дисперсные системы подразделяют на:- свободнодисперсные (бесструктурные);
- связнодисперсные (структурированные).
В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения.
Список использованной литературы
- Гельфман М. И., Ковалевич О. В., Юстратов В. П. Коллоидная химия. 2-е изд., стер. - СПб.: Издательство "Лань", 2004. - 336 с.: ил. ISBN 5-8114-0478-6 [с. 8-10]
Дисперсионные системы можно разделить по размеру частиц дисперсионной фазы. Если размер частиц составляет меньше одного нм – это молекулярно - ионные системы, от одного до ста нм - коллоидные, и более ста нм - грубодисперсные. Группу молекулярно дисперсных систем представляют растворы. Это однородные системы, которые состоят из двух или более веществ и являются однофазными. К ним относятся газ, твердое вещество или растворы. В свою очередь эти системы можно разделить на подгруппы:
- Молекулярные. Когда органические вещества, такие как глюкоза, соединяются с неэлектролитами. Такие растворы назвали истинными для того, чтобы можно было отличать от коллоидных. К ним относятся растворы глюкозы, сахарозы, спиртовые и другие.
- Молекулярно-ионные. В случае взаимодействия между собой слабых электролитов. В эту группу входят кислотные растворы, азотистые, сероводородные и другие.
- Ионные. Соединение сильных электролитов. Яркие представители - это растворы щелочей, солей и некоторых кислот.
Коллоидные системы
Коллоидные системы - это микрогетерогенные системы, в которых размеры коллоидных частиц варьируют от 100 до 1 нм. Они длительное время могут не выпадать в осадок за счет сольватной ионной оболочки и электрического заряда. При распределении в среде коллоидные растворы заполняют равномерно весь объем и делятся на золи и гели, которые в свою очередь представляют собой осадки в виде студня. К ним относятся раствор альбумина, желатина, коллоидные растворы серебра. Холодец, суфле, пудинги - это яркие коллоидной систем, встречающихся в повседневной жизни.
Грубодисперсные системы
Непрозрачные системы или взвеси, в которых мелкие ингредиенты частицы видны невооруженным глазом. В процессе отстаивания дисперсная фаза легко отделяется от дисперсной среды. Они подразделяются на суспензии, эмульсии, аэрозоли. Системы, в которых в жидкой дисперсионной среде размещаются твердое вещество с более крупными частицами, называются суспензиями. К ним относятся водные растворы крахмала и глины. В отличие от суспензий, эмульсии получаются в результате смешивания двух жидкостей, в которых одна капельками распределяется в другой. Примером эмульсии является смесь масла с водой, капельки жира в молоке. Если мелкие твердые или жидкие частицы распределяется в газе - это аэрозоли. По сути аэрозоль - это суспензия в газе. Одним из представителей аэрозоля на основе жидкости является туман - это большое количество мелких водяных капелек, взвешенных в воздухе. Твердотельный аэрозоль – дым или пыль - множественное скопление мелких твердых частиц также взвешенных в воздухе.
Дисперсные системы.
Дисперсные системы широко распространены в природе и с давних времен используются человеком в его жизнедеятельности. Практически любой живой организм либо представляет собой дисперсную систему, либо содержит их в различных формах.
Пример: свободнодисперсные системы (нет сплошных жестких структур - золи): кровь, лимфа, желудочный и кишечный соки, спинномозговая жидкость и т.д.
связнодисперсные системы (есть жесткие пространственные структуры - гели): протоплазма, мембраны клеток, мышечное волокно, хрусталик глаза и т.д.
Дисперсные системы активно применяют в медицине, это в первую очередь коллоидные растворы, аэрозоли, кремы, мази. Биохимические процессы в организме протекают в дисперсных системах. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биожидкости (дисперсные системы) участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа).
Знание закономерностей физико-химических процессов в дисперсных системах важно будущим врачам как для изучения медико-биологических и клинических дисциплин, так и для более глубокого понимания процессов, протекающих в организме, и сознательного изменения их в желаемом направлении.
Дисперсные системы – это многокомпонентные системы, в которых одни вещества в виде мелких частиц распределены в другом веществе. Вещество, которое распределяется, называется дисперсной фазой. Вещество, в котором распределяется дисперсная фаза, называется дисперсионной средой.
Пример: водный раствор глюкозы
молекулы глюкозы – дисперсная фаза
вода – дисперсионная среда
Дисперсность – величина, характеризующая размер взвешенных частиц в дисперсных системах. Она обратна диаметру частиц дисперсной фазы. Чем меньше размер частиц, тем больше дисперсность.
Классификация дисперсных систем.
Дисперсные системы классифицируют по пяти признакам.
1. По степени дисперсности:
· грубодисперсные
Д = 10 4 – 10 6 м –1 , характеризуются неустойчивостью, непрозрачностью.
Пример: суспензии, эмульсии, пены, взвеси.
· коллоидно-дисперсные
Д = 10 7 – 10 9 м –1 , могут быть прозрачными и мутными, обладать устойчивостью и быть неустойчивыми.
Пример: коллоидные растворы, растворы высокомолекулярных соединений.
· молекулярно-дисперсные и ионно-дисперсные
Д = 10 10 – 10 11 м –1 , характеризуются прозрачностью и устойчивостью.
Пример: растворы низкомолекулярных соединений.
2. По наличию физической поверхности раздела между дисперсной фазой и дисперсионной средой:
· гомогенные (однофазные системы, граница раздела отсутствует.
Пример: растворы низкомолекулярных и высокомолекулярных соединений.
· гетерогенные
существует граница раздела между дисперсной фазой и дисперсионной средой.
Пример: коллоидные растворы и грубодисперсные системы.
3. По характеру взаимодействия между дисперсной фазой и дисперсионной средой:
· лиофильные
между дисперсной фазой и дисперсионной средой существует сродство.
Пример: все гомогенные системы.
· лиофобные
между дисперсной фазой и дисперсионной средой слабое взаимодействие или отсутствует.
Пример: все гетерогенные системы.
4. По агрегатному состоянию дисперсной фазы и дисперсионной среды:
| дисп.фаза дисп.среда | газообразная | твердая | жидкая |
| газообразная | смесь газов (воздух) | табачный дым пыль мучная, космическая аэрозоли | туман пар облака |
| жидкая | растворенный в крови CO 2 , O 2 , N 2 , пены минеральные воды фруктовые газированные напитки | коллоидные растворы суспензии растворы ВМС растворы НМС | эмульсии: молоко масло сливочное маргарин кремы мази нефть |
| твердая | твердые пены (пенопласт, активированный уголь) ионообменные смолы молекулярные сита | сплавы металла цветные стекла, хрусталь драгоценные камни (рубин, аметист) суппозитории (лечебные свечи) | кристаллогидраты минералы с жидкими включениями (жемчуг, опал) влажные почвы |
5. По природе дисперсионной среды:
Истинные растворы.
Истинный раствор – это гомогенная лиофильная дисперсная система с размерами частиц 10 –10 – 10 –11 м.
Истинные растворы – это однофазные дисперсные системы, они характеризуются большой прочностью связи между дисперсной фазой и дисперсионной средой. Истинный раствор сохраняет гомогенность неопределенно долгое время. Истинные растворы всегда прозрачны. Частицы истинного раствора не видны даже в электронный микроскоп. Истинные растворы хорошо диффундируют.
Компонент, агрегатное состояние которого не изменяется при образовании раствора, называют растворителем (дисперсионная среда), а другой компонент – растворенным веществом (дисперсная фаза).
При одинаковом агрегатном состоянии компонентов растворителем считается компонент, количество которого в растворе преобладает.
В растворах электролитов вне зависимости от соотношения компонентов электролиты рассматриваются как растворенные вещества.

Истинные растворы подразделяются:
· по типу растворителя: водные и неводные
· по типу растворенного вещества: растворы солей, кислот, щелочей, газов и т.д.
· по отношению к электрическому току: электролиты и неэлектролиты
· по концентрации: концентрированные и разбавленные
· по степени достижения предела растворимости: насыщенные и ненасыщенные
· с термодинамической точки зрения: идеальные и реальные
· по агрегатному состоянию: газообразные, жидкие, твердые

Истинные растворы бывают:
· ионно-дисперсные (дисперсная фаза – гидратированные ионы): водный раствор NaCl
· молекулярно-дисперсные (дисперсная фаза – молекулы): водный раствор глюкозы
Ионы каждый в отдельности или совместно выполняют определённые функции в организме. Решающая роль в переносе воды в организме принадлежит ионам Na + и Cl – , т.е участвуют в водно-солевом обмене. Ионы электролитов участвуют в процессах поддержания постоянства осмотического давления, установления кислотно-щелочного равновесия, в процессах передачи нервных импульсов, в процессах активации ферментов.
С позиции живых систем наибольший интерес представляют растворы, в которых растворителем является вода.
В ней растворяется огромное число веществ. Она не только растворитель, который обеспечивает молекулярное рассеяние веществ по всему организму. Она также является участником многих химических и биохимических процессов в организме. Например, гидролиза, гидратации, набухания, транспорта питательных и лекарственных веществ, газов, антител и т.п.
В организме происходит непрерывный обмен воды и растворённых в ней веществ. Вода составляет основную массу любого живого существа. Её содержание в теле человека меняется с возрастом: у эмбриона человека – 97%, у новорождённого – 77%, у взрослых мужчин – 61%, у взрослых женщин – 54%, у стариков старше 81 года – 49,8%. Большая часть воды в организме находится внутри клеток (70%), около 23% – межклеточной воды, а остальная (7%) – находится внутри кровеносных сосудов и в составе плазмы крови.
Всего в организме 42 л воды. В сутки поступает в организм и выводится из него 1,5 – 3 л воды. Это нормальный водный баланс организма.
Главный путь выведения воды из организма – почки. Потеря 10 – 15% воды опасна, а 20 – 25% смертельна для организма.
Важнейшей характеристикой раствора является его концентрация.
Способы выражения концентрации растворов:
1. Массовая доля w(х) – величина, равная отношению массы растворённого вещества m(x) к массе раствора m(p-p)
w (x) = × 100%
2. Молярная концентрация раствора с (х) – величина, равная отношению количества вещества n(х), содержащегося в растворе, к объёму этого раствора V(р-р).
с (х) = [моль/л], где n(х) = [моль]
Миллимолярный раствор – раствор с молярной концентрацией равной 0,001 моль/л
Сантимолярный раствор – раствор с молярной концентрацией равной 0,01 моль/л
Децимолярный раствор – раствор с молярной концентрацией равной 0,1 моль/л
3. Молярная концентрация эквивалента с ( x) – величина, равная отношению количества вещества эквивалента n ( x) в растворе к объёму этого раствора.
c ( x) = [моль/л], где n ( x) = [моль], а М( x) = × М(x)
Эквивалент – это реальная или условная частица вещества х , которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной ОВР – одному электрону.
Число эквивалентности z и фактор эквивалентности f = . Фактор эквивалентности показывает, какая доля реальной частицы вещества х эквивалентна одному иону водорода или одному электрону. Число эквивалентности z равно для:
а) кислот – основности кислоты H 2 SO 4 z = 2.
б) оснований – кислотности основания Aℓ(OH) 3 z = 3.
в) солей – произведению степени окисления (с.о.) металла на число его атомов в молекуле Fe 2 (SO 4) 3 z = 2 × 3 = 6.
г) окислителей – числу присоединенных электронов
Mn +7 + 5ē → Mn +2 z = 5
д) восстановителей – числу отданных электронов
Fe +2 – 1ē → Fe +3 z = 1
4. Моляльная концентрация b(x) – величина, равная отношению количества вещества к массе растворителя (кг)
b(x) = = [моль/кг]
5. Молярная доля c(x i) равна отношению количества вещества данного компонента к суммарному количеству всех компонентов раствора
Формулы взаимосвязи концентраций:
с ( x) = c (x) × z
У растворов имеется ряд свойств, которые не зависят от природы растворенного вещества, а зависят только от его концентрации. Наиболее важным является осмос.
Благодаря осмосу через мембраны клеток органов и тканей осуществляется сложный процесс обмена веществ организма с внешней средой.
Диффузия – процесс самопроизвольного выравнивания концентрации в единице объема.
Осмос – односторонняя диффузия молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
раствор растворитель


Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса - обратной диффузии растворителя. Обратный осмос имеет место при фильтрации плазмы крови в артериальной части капилляра и в почечных клубочках.
Осмотическое давление – давление, которое нужно приложить к раствору, чтобы осмос прекратился.
Уравнение Вант-Гоффа: Р осм = c RT×10 3
Осмотическое давление крови: 780 – 820 кПа
Все растворы, с точки зрения осмотических явлений, можно разделить на 3 группы:
· Изотонические растворы – растворы, имеющие одинаковые осмотические давления и осмолярные концентрации. Примеры: желчь, раствор NaCl (w=0,9%, с=0,15 моль/л), раствор глюкозы (w=7%, с=0,3 моль/л)
Осмолярная концентрация (осмолярность) – суммарное количество вещества всех кинетически активных частиц, содержащихся в 1 литре раствора. с осм, осмоль/л
Осмоляльная концентрация (осмоляльность) – суммарное количество вещества всех кинетически активных частиц, содержащихся в 1 кг растворителя. b осм, осмоль/кг
Для разбавленных растворов осмолярная концентрация совпадает с осмоляльной концентрацией. с осм ≈ b осм
· Гипертонический раствор – раствор с более высокой концентрацией растворенных веществ, следовательно, с более высоким осмотическим давлением по сравнению с другим раствором и способный при наличии проницаемых мембран вытягивать из него воду. Примеры: кишечный сок, моча.
· Гипотонический раствор – раствор с более низкой концентрацией растворенных веществ, следовательно, с более низким осмотическим давлением по сравнению с другим раствором и способный при наличии проницаемых мембран терять воду. Примеры: слюна, пот.
Животные и растительные клетки отделены от окружающей среды мембраной. При помещении клетки в различные по осмолярным концентрациям или давлениям растворы будут наблюдаться следующие явления:
· плазмолиз – уменьшение клетки в объеме. При этом клетку помещают в гипертонический раствор. Разность осмотических давлений вызывает перемещение растворителя из клетки в гипертонический раствор.
· лизис – увеличение клетки в объеме. При этом клетку помещают в гипотонический раствор. Разность осмотических давлений вызывает перемещение растворителя в клетку. В случае разрыва эритроцитарных мембран и перехода гемоглобина в плазму явление называется гемолизом.
· изоосмия – объем клетки не изменяется. При этом клетку помещают в изотонический раствор.

С помощью осмотических явлений поддерживается водно-солевой обмен в организме человека. Осмос – это основа механизма работы почек. Изотонический (физиологический) раствор NaCl (0,9%) используется при больших кровопотерях. Гипертонический раствор NaCl (10%) используют при накладывании марлевых повязок на гнойные раны.
Онкотическое давление – это часть осмотического давления, создаваемого белками.
В плазме крови человека составляет лишь около 0,5 % осмотического давления (0,03-0,04 атм или 2,5 – 4,0 кПа). Тем не менее, онкотическое давление играет важнейшую роль в образовании межклеточной жидкости, первичной мочи и др. Стенка капилляров свободно проницаема для воды и низкомолекулярных веществ, но не для белков. Скорость фильтрации жидкости через стенку капилляра определяется разницей между онкотическим давлением белков плазмы и гидростатическим давлением крови, создаваемым работой сердца. На артериальном конце капилляра солевой раствор вместе с питательными веществами переходит в межклеточное пространство. На венозном конце капилляра процесс идёт в противоположном направлении, поскольку венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. При заболеваниях, сопровождающихся уменьшением концентрации в крови белков (особенно альбуминов), онкотическое давление снижается, и это может явиться одной из причин накопления жидкости в межклеточном пространстве, в результате чего развиваются отёки.
 |
), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза ) мелко распределено во втором (дисперсионная среда ). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы - это коллоидные растворы , золи . К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами - полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.
По размерам частиц свободнодисперсные системы подразделяют на:
Ультрамикрогетерогенные системы также называют коллоидными или золями . В зависимости от природы дисперсионной среды, золи подразделяют на твёрдые золи, аэрозоли (золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой). К микрогетерогенным системам относят суспензии , эмульсии , пены и порошки. Наиболее распространёнными грубодисперсными системами являются системы «твёрдое - газ», например, песок.
Связнодисперсные системы (пористые тела) по классификации М. М. Дубинина подразделяют на:
Wikimedia Foundation . 2010 .
Смотреть что такое "Дисперсная система" в других словарях:
дисперсная система - дисперсная система: Система, состоящая из двух или более фаз (тел) с сильно развитой поверхностью раздела между ними. [ГОСТ Р 51109 97, статья 5.6] Источник … Словарь-справочник терминов нормативно-технической документации
дисперсная система - Система, состоящая из двух или более фаз (тел) с сильно развитой поверхностью раздела между ними. [ГОСТ Р 51109 97] [ГОСТ Р 12.4.233 2007] Тематики промышленная чистотасредства индивидуальной защиты … Справочник технического переводчика
дисперсная система - – гетерогенная система, состоящая из двух фаз или более, характеризующаяся сильно развитой поверхностью раздела между ними. Общая химия: учебник / А. В. Жолнин … Химические термины
дисперсная система - ▲ механическая смесь мелкий дисперсная система гетерогенная система, в которой частицы одной фазы (дисперсной) распределены в другой однородной фазе (дисперсионной среде). пена (клочья пены). пенка. пенить, ся. вспениться. пенистый. пенный.… … Идеографический словарь русского языка
дисперсная система - dispersinė sistema statusas T sritis chemija apibrėžtis Sistema, susidedanti iš dispersinės fazės ir dispersinės terpės (aplinkos). atitikmenys: angl. disperse system; dispersion rus. дисперсия; дисперсная система ryšiai: sinonimas – dispersija … Chemijos terminų aiškinamasis žodynas
дисперсная система - dispersinė sistema statusas T sritis fizika atitikmenys: angl. disperse system vok. disperses System, n rus. дисперсная система, n pranc. système dispersé, m … Fizikos terminų žodynas
дисперсная система - гетерогенная система из двух или большего числа фаз с сильно развитой поверхностью раздела между ними. В дисперсной системе, по крайней мере одна из фаз (ее называют дисперсной) включается в виде мелких частиц в другую… … Энциклопедический словарь по металлургии
Физико механическая система, состоящая из дисперсной фазы и дисперсионной среды. Различают грубодисперсные и высокодисперсные (коллоидные) системы.