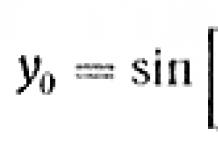План лекции
1. Азот. Положение в ПС. Степени окисления. Нахождение в природе. Физические и химические свойства.
2. Водородные соединения азота (аммиак, гидразин, гидроксиламин, азотистоводородная кислота).
3. Кислородные соединения азота (оксиды азота, азотноватистая, азотистая и азотная кислоты).
4. Фосфор. Физические и химические свойства. Водородные и кислородные соединения.
5. Азотные и фосфорные удобрения.
14.1 Азот. Положение в ПС. Степени окисления. Нахождение в природе. Физические и химические свойства
Азот – это p-элемент 5 группы ПС. На валентном слое у него 5 электронов (2s 2 2p 3). Степени окисления -3,-2,-1, 0, +1, +2, +3, +4, +5. Это типичный неметалл.
Общее содержание азота земной коры насчитывается около 0,03%. Наибольшая его часть сосредоточена в атмосфере, основную массу которой (75,6 вес.%) и составляет свободный азот (N 2). Сложные органические производные азота входят в состав всех живых организмов. В результате отмирания этих живых организмов и тления их останков образуются более простые азотные соединения, которые при благоприятных условиях (главным образом – отсутствие влаги) могут накапливаться в земной коре.
При обычных условиях азот представляет собой бесцветный не имеющий запаха газ. Бесцветен он также в жидком и твёрдом состоянии.
Свободный азот химически весьма инертен. Между атомами в молекуле азота тройная связь (энергия связи 940 кдж/моль). При обычных условиях он практически не реагирует ни с металлами (кроме Li и Mg), ни с неметаллами. Нагревание увеличивает его химическую активность главным образом по отношению к металлам, с некоторыми из которых он соединяется, образуя нитриды. При температуре 3000 0 С он реагирует с кислородом воздуха.
14.2 Водородные соединения азота (аммиак, гидразин и гидроксиламин)
Формулы водородных соединений, соответственно:
NH 3 , N 2 H 4 , NH 2 OH, HN 3 .
Аммиак представляет собой бесцветный газ с характерным резким запахом (“нашатырного спирта”). Растворимость его в воде больше, чем всех других газов: один объём воды поглощает при 0ºС около 1200, а при 20º С – около 700 объёмов NH 3 .
Гидразин N 2 H 4 представляет собой бесцветную жидкость, дымящую на воздухе и легко смешивающуюся с водой, а гидроксиламин NH 2 OH представляет собой бесцветные кристаллы, хорошо растворимые в воде.
Для химической характеристики аммиака, гидразина и гидроксиламина основное значение имеют реакции трёх типов: присоединения, замещения водорода и окисления.
При растворении в воде часть молекул аммиака химически реагирует с водой, образуя слабое основание (K d = 1,8×10 -5).
NH 3 + H 2 O ↔ NH 4 OH ↔ NH 4 + + OH¯
Гидразин и гидроксиламин тоже частично реагируют с водой. Растворы этих веществ являются более слабыми основаниями по сравнению с аммиаком (K d = 8,5×10 -7 и K d = 2∙10 -8).
Азотистоводородная кислота HN 3 представляет собой бесцветную, обладающую острым запахом жидкость, ее ядовитые, разъедающие слизистые оболочки, пары при соприкосновении с нагретыми предметами с большой силой взрываются.
В водных растворах кислота устойчива. Это слабая (несколько слабее уксусной) кислота (K = 1,2∙10-5), диссоциирующая по схеме:
HN 3 ↔ H + + N 3 -
Соли называются азидами, врывчаты (детонаторы).
14.3 Кислородные соединения азота (оксиды азота, азотная и азотистая кислоты)
Азот образует оксиды: N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 5 . Все оксиды газообразные вещества при обычных условиях, кроме N 2 O 5 (бесцветное кристаллическое вещество).
Первые два несолеобразующие, а остальные являются кислотными.
N 2 O 3 - ангидрид азотистой кислоты (HNO 2).
NO 2 - ангидрид азотистой (HNO 2) . и азотной (HNO 3) кислот.
N 2 O 5 – ангидрид азотной кислоты.
Азот образует несколько кислот: H 2 N 2 O 2 – азотноватистая, HNO 2 – азотистая, HNO 3 – азотная.
Азотноватистая кислота H 2 N 2 O 2 кристаллическое вещество белого цвета, взрывчатое, легко растворимое в воде. В водном растворе это слабая, умеренно устойчивая, двухосновная кислота (K 1 d = 9×10 -8 и K 2 d = 10 -11).
Азотистая кислота HNO 2 слабая и неустойчивая одноосновная кислота (Kd = 5×10 -4), существующая в водных растворах. Соли нитриты устойчивы. Азотистая кислота и ее соли проявляют окислительно-восстановительную двойственность, поскольку содержат азот в промежуточной степени окисления (+3).
Чистаяазотная кислота HNO 3 -бесцветная жидкость плотностью 1,51 г/см при – 42°С застывающая в прозрачную кристаллическую массу
Азотная кислота принадлежит к числу наиболее сильных кислот, в разбавленных водных растворах она полностью распадается на ионы:
HNO 3 → Н + + NO 3 ¯.
Азотная кислота является сильным окислителем. Она окисляет металлы до солей, а неметаллы до высших кислородных кислот. При этом она восстанавливается в концентрированных растворах до диоксида азота, а в разбавленных в продуктах ее восстановления в зависимости от активности металла могут быть N 2 , NO, N 2 O, N 2 O 3 , NH 4 NO 3 .
Азотная кислота не действует на золото, платину, родий и иридий. Некоторые металлы пассивируются (покрываются защитной пленкой) в концентрированной азотной кислоте. Это алюминий, железо и хром.
Соли азотной кислоты – нитраты. Хорошо растворяются в воде, устойчивы при обычных условиях. При нагревании распадаются с выделением кислорода.
14.4 Фосфор. Физические и химические свойства. Водородные и кислородные соединения
Для твёрдого фосфора известно несколько аллотропических модификаций, из которых практически приходится встречаться только с двумя: белой и красной.
При хранении белый фосфор постепенно (очень медленно) переходит в более устойчивую красную форму. Переход сопровождается выделением тепла (теплота перехода):
P белый = P красный + 4 ккал
Химическая активность фосфора значительно выше, чем у азота. Так, он легко соединяется с кислородом, галоидами, серой и многими металлами. В последнем случае образуется аналогичные нитридам фосфиды (Mg 3 P 2 , Ca 3 P 2 и др.).
Водородные соединения фосфора – это фосфин (PH 3) и дифосфин (P 2 H 4).
Дифосфин (P 2 H 4) – жидкий фофористый водород, самовоспламеняющийся на воздухе (блуждающие огни на кладбище объясняются образованием этого вещества при тлении останков).
Фосфористый водород (“фосфин”) – PH 3 представляет собой бесцветный газ с неприятным запахом (“гнилой рыбы”). Фосфин является очень сильным восстановителем (фосфор имеет степень окисления –3) и весьма ядовит. В противоположность аммиаку реакции присоединения для фосфина мало характерны. Соли фосфония известны лишь для немногих сильных кислот и весьма нестойки, а с водой фосфин химически не взаимодействует (хотя довольно хорошо растворим в ней).
Кислородные соединения фосфора - оксиды P 2 O 3 и P 2 O 5 ,существующие в виде димеров (P 2 O 3) 2 и (P 2 O 5) 2 , а также кислоты: H 3 PO 2 – фосфорноватистая, H 3 PO 3 – фосфористая, H 3 PO 4 – фосфорная.
Горение фосфора при недостатке воздуха или медленное окисление даёт главным образом фосфористый ангидрид (P 2 O 3). Последний представляет собой белую (похожую на воск) кристаллическую массу. При нагревании на воздухе он переходит в P 2 O 5 (белую снегообразную массу). Взаимодействуя с холодной водой, P 2 O 3 медленно образует фосфористую кислоту:
P 2 O 3 + 3H 2 O = 2H 3 PO 3
P 2 O 5 - высший оксид – фосфорный ангидрид получается при сгорании фосфора в избытке кислорода (или воздуха). Фосфорный ангидрид (P 2 O 5) чрезвычайно энергично притягивает влагу и поэтому часто применяется в качестве осушителя газов.
Взаимодействие P 2 O 5 с водой в зависимости от числа присоединённых молекул H 2 O приводит к образованию следующих гидратных форм:
P 2 O 5 + H 2 O = 2HPO 3 (метафосфорная)
P 2 O 5 + 2H 2 O = H 4 P 2 O 7 (пирофосфорная кислота)
P 2 O 5 + 3H 2 O = 2H 3 PO 4 (ортофосфорная кислота)
H 3 PO 2 (фосфорноватистая кислота) - это бесцветное кристаллическое вещество. В водном растворе сильная одноосновная кислота. Она самая сильная среди кислот фоссфора. Сама кислота и ее соли (гипофосфиты) являются восстановителями.
Свободная фосфористая кислота (H 3 PO 3 ) представляет собой бесцветные кристаллы, расплывающиеся на воздухе и легкорастворимые в воде. Она является сильным (но в большинстве случаев медленно действующим) восстановителем. Несмотря на наличие в молекуле трёх водородов, H 3 PO 3 функционирует только как двухосновная кислота средней силы. Соли её (фосфористокислые или фосфиты), как правило, бесцветны и плохо растворимы в воде. Из производных чаще встречающихся металлов хорошо растворимы лишь соли Na, K, Ca.
Наибольшее практическое значение из кислот пятивалентного фосфора имеет ортогидрат (H 3 PO 4).
Фосфорная кислота представляет собой бесцветные, расплывающиеся на воздухе кристаллы. Продаётся она обычно в виде 85%-ного водного раствора, приблизительно отвечающего составу 2H 3 PO 4 H 2 O и имеющего консистенцию густого сиропа. В отличии от многих других производных фосфора, H 3 PO 4 неядовита. Окислительные свойства для неё вовсе не характерны.
Будучи трёхосновной кислотой средней силы, H 3 PO 4 способна образовывать три ряда солей, например: кислые соли Na 2 HPO 4 и Na 2 HPO 4 , а также среднюю соль - Na 3 PO 4
NaH 2 PO 4 - дигидрофосфат натрия (первичный фосфорнокислый натрий)
Na 2 HPO 4 - гидрофосфат натрия (вторичный фосфорнокислый натрий)
Na 3 PO 4 – фосфат натрия (третичный фосфорнокислый натрий).
14.5 Азотные и фосфорные удобрения.
Азот и фосфор – это макроэлементы, которые необходимы растительным и животным организмам в больших количествах. Азот входит в состав белка. Фосфор входит в состав костей. Органические производные фосфорной кислоты являются источниками энергии для эндотермических реакций клетки.
Азотные удобрения это соли азотной кислоты: KNO 3 – калийная селитра, NaNO 3 – натриевая селитра, NH 4 NO 3 – аммонийная селитра, Ca(NO 3) 2 – норвежская селитра. Растворы аммиака в воде – жидкое азотное удобрение.
Фосфорные удобрения это соли фосфорной кислоты: Ca(H 2 PO 4) 2 ×2CaSO 4 – простой суперфосфат, Ca(H 2 PO 4) 2 – двойной суперфосфат, CaHPO 4 ×2H 2 O –преципитат. Макроудобрения вносятся в почву в больших количествах (в центнерах на гектар).
NH 4 NO 3 → N 2 O + 2H 2 O
NH 4 NO 3 → N 2 + NO + H 2 O
Нитриты не разлагаются, кроме NH 4 NO 2
NH 4 NO 2 → N 2 + 2H 2 O
Получение азотной кислоты
В лабораторных условиях – KNO 3тв + H 2 SO 4 k = KHSO 4 + HNO 3
В промышленности: аммиачный или контактный способ.
Каталитическое окисление в контактном аппарате (катализатор – платинородиевые сетки)
1) 4NH 3 + 5O 2 → 4NO + 6H 2 O
2) NO + O 2 → NO 2 при обычной t и повышенном P ≈ 600 – 1100 кПа
3)4NO 2 + O 2 + H 2 O → 4HNO 3 ω (50 – 60%)
Соли азотной кислоты. Азотные удобрения
Нитраты – практически все хорошо растворимы в H 2 O, поэтому природные месторождения редки. Основное количество получают искусственным путем на химических заводах, из HNO 3 и гидроксидов.
Получают:
1) Взаимодействием с металлами, основаниями, амфотерными основаниями щелочами, нерастворимыми основаниями, аммиаком или его водным раствором, с некоторыми солями.
2) NO 2 с растворами щелочей
2Ca(OH) 2 + NO 2 = Ca(NO 3) 2 + Ca(NO 2) 2 + 2H 2 O
В кислой среде нитраты проявляют окислительные свойства подобно разбавленной HNO 3
3FeCl 2 + KNO 3 + 4HCl = 3FeCl 3 + KCl + NO + H 2 O
В щелочной окисляют активные металлы (Mg, Al, Zn)
4Zn + NaNO 3 + 7NaOH + 6H 2 O = 4Na 2 + NH 3
Наиболее сильные окислительные свойства нитраты проявляют при сплавлении
Cr 2 O 3 + 3NaNO 3 + 4KOH = 3K 2 CrO 4 + 3NaNO 2 + 2H 2 O
Наиболее важные азотные удобрения:
Нитраты натрия, калия, аммония и кальция применяются главным образом как минеральные азотные удобрения и называются селитрами .
NH 4 NO 3 (NH 4) 2 SO 4 сульфат аммония
KNO 3 селитры NH 3 H 2 O аммиачная вода
NaNO 3 NH 4 H 2 PO 4 аммофос
Ca(NO 3) 2 (NH 4) 2 HPO 4 диаммофос
CO(NH 2) 2 мочевина, карбамид
Питательная ценность удобрения растворяется по ω(N) в нем.
В мочевине ω(N) = (2 14)/ (12 + 16 + 28 + 4)= 28/60 = 0,47 (47%).
В NH 4 NO 3 – азот в нитратной и аммиачной форме (35%), (NH 4) 2 SO 4 – наиболее ценное удобрение, так как азота больше всего в хорошо усвояемой форме.
К азотным удобрениям, как источникам азотного питания растений для повышения урожайности относят также органические удобрения (навоз, компост и др.), а также зеленые удобрения (люпин).
Химия фосфора
Фосфор (лат. Phosphorus) - один из наиболее распространенных элементов в земной коре. В свободном состоянии в природе не встречается из-за высокой химической активности. В связанном виде входит в состав около 200 минералов, главным образом апатитов 3Ca 3 (PO 4) 2 *CаХ 2 (Х=Cl, F, OH) 2 и фосфоритов Ca 3 (PO 4) 2 .
Известно 11 аллотропных модификаций фосфора, наиболее изучен белый, красный и черный фосфор. Белый фосфор
имеет молекулярную формулу P 4 и представляет правильный тетраэдр с углом между связями в 60 О. 
Белый фосфор очень ядовит. Смертельная доза для человека составляет 0,15 г. Уже при комнатной температуре белый фосфор легко испаряется и его пары окисляются. Энергия этих реакций переходит частично в световую, что является причиной свечения белого фосфора в темноте.
Он легко загорается (возможно самовоспламенение). Обращаться с ним надо крайне осторожно. Хранить необходимо под водой.
Красный фосфор получают при длительном нагревании белого фосфора при температуре 280-340 О С под давлением и без доступа воздуха. Это темно-красное мелкокристаллическое мало-летучее вещество.
280 - 340° С 200° С
P бел → Р красн P бел → Р черн
Красный фосфор почти не ядовит и менее огнеопасен, чем белый. Самовозгорание не происходит, однако зажечь его легко и горение протекает очень бурно.
В основе полимеры, получаются размыканием тетраэдра P 4 .
Наиболее устойчивой формой фосфора является черный фосфор . По внешнему виду и свойствам напоминает графит, жирный на ощупь, разделяется на чешуйки, проводит электрический ток. Не ядовит, химически наименее малоактивен, воспламеняется только при температуре 490 О С.
Хотя фосфор является электронным аналогом азота, но наличие в валентном электронном слое атома свободных d - орбиталей делает соединения фосфора не похожими на соединения азота.
Различие между соединениями азота и фосфора связано с образованием донорно-акцепторных π-связей между атомами фосфора и донорами электронных пар, особенно кислородом. Поэтому при переходе от N к P прочность связей Э-Н вследствие увеличения размера атома снижается, однако связи Э-О значительно упрочнятся.
Образование донорно-акцепторных связей объясняет интенсивное взаимодействие фосфора с кислородом, устойчивость и многообразие кислородных соединений фосфора.
Наиболее устойчивая степень окисления +5. В этой степени окисления соединения фосфора не проявляют окислительные свойства из-за ее стабильности, в отличии от азота. Т.к. имеются свободные 3d – орбитали, то по сравнению с азотом валентных возможностей больше и максимальная валентность фосфора может быть 5, редко 6.
Получение:
1. Из фосфоритной муки сплавлением с углеродом и оксидом кремния
Ca 3 (PO 4) 2 + C +SiO 2 → P 4 + CaSiO 3 + CO
2. Из фосфата Са, при температуре выше 1500 о С
Ca 3 (PO 4) 2 + C → CaO + P 4 + CO
Химические свойства:
P + O 2 = P 2 O 3
P + O 2 = P 2 O 5
P + S = P 2 S 3
P + Cl 2 = PCl 3
Азотная кислота HNO3 в чистом виде — бесцветная жидкость с резким удушливым запахом. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет: 4НNО3 = 4NО2 + 2Н2О + О2. Азотная кислота принадлежит к числу…
При нагревании твердых нитратов все они разлагаются с выделением кислорода (исключением является нитрат аммония), при этом их можно разделить на четыре группы. Первую группу составляют нитраты щелочных металлов, которые при нагревании разлагаются на нитриты и кислород: 2КNО3 = 2КNО2 + О2. Вторую группу составляет большинство нитратов (от щелочноземельных металлов до меди включительно), разлагающихся на оксид металла, NО2 и кислород: 2Сu(NО3)2 = 2СuО + 4NО2 + O2, Третью группу составляют нитраты наиболее тяжелых металлов (АgNО3 и Нg(NО3)2), разлагающиеся до свободного металла, NО2 и кислорода: Hg(NО3)2 = Нg + 2NО2 + О2, Четвертую «группу» составляет нитрат аммония: NН4NО3 = N2О + 2Н2O.
![]()
Азотистая кислота НNО2 принадлежит к слабым кислотам (К = 6.10-4 при 25 °С), неустойчива и известна лишь в разбавленных растворах, в которых осуществляется равновесие 2НNО2 NО + NО2 + Н2О. Нитриты в отличие от самой кислоты устойчивы даже при нагревании. Исключением является кристаллический нитрит аммония, который при нагревании разлагается на свободный азот и воду.
Из трех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота Н3РО4 (часто ее называют просто фосфорной) — белое твердое вещество, хорошо растворимое в воде. В водном растворе она диссоциирует ступенчато. Как трехосновная, фосфорная кислота образует три типа солей: дигидрофосфаты (NаН2РО4); гидрофосфаты (Nа2НРО4); фосфаты (Na3РО4). Все дигидрофосфаты растворимы в воде. Из гидрофосфатов и фосфатов в воде растворимы только соли щелочных металлов и аммония. Соли фосфорной кислоты являются ценными минеральными удобрениями. Наиболее распространенные среди них — суперфосфат, преципитат и фосфоритная мука. Простой суперфосфат — смесь дигидрофосфата кальция Са(Н2РО4)2 и «балласта» СаSО4. Его получают, обрабатывая фосфориты и апатиты серной кислотой. При обработке минеральных фосфатов фосфорной кислотой получают двойной суперфосфат Са(Н2РО4)2. При гашении фосфорной кислоты известью получают преципитат СаНРО4.2Н2О. Важное значение имеют сложные удобрения (т.е. содержащие одновременно азот и фосфор; или азот, фосфор и калий). Из них наиболее известен аммофос — смесь NН4Н2РО4 и (NН4)2НРО4.
В обычных условиях — бесцветный газ, с резким запахом (запахом «нашатыря»); сжижается при -33,4 °С и затвердевает при -77,7 °С. Молекула аммиака имеет форму пирамиды, в жидком аммиаке молекулы NН3 связаны водородными связями, обусловливая тем самым аномально высокую температуру кипения. Полярные молекулы NH3 очень хорошо растворимы в воде (700 объемов NН3 в одном объеме Н2О)…
Фосфор образует два хлорида: трихлорид фосфора PCl3 и пентахлорид фосфора РCl5. Трихлорид фосфора получают, пропуская хлор над поверхностью белого фосфора. При этом фосфор горит бледно-зеленым пламенем, а образующийся хлорид фосфора конденсируется в виде бесцветной жидкости. Трихлорид фосфора гидролизуется водой с образованием фосфористой кислоты и хлороводорода: РCl3 + ЗН2О = Н3РО3 + ЗНСl. Пентахлорид фосфора можно получить в лабораторных условиях…
![]()
В оксидах степень окисления азота меняется от +1 до +5. Оксиды N2О и NO — бесцветные газы, оксид азот (IV) NO2 — бурый газ, получивший в промышленности название «лисий хвост». Оксид азота (III) N2О3 — синяя жидкость, оксид азота (V) N2O5 при обычных условиях — прозрачные бесцветные кристаллы. Часто используется тривиальное название оксида азота (I)…
Фосфорный ангидрид Р2О5 («простейшая» формула) является наиболее стабильным оксидом фосфора при обычных условиях. Это — твердое белое вещество состава Р4О10. Фосфористый ангидрид описывается простейшей формулой Р2O3 и истинной формулой Р4О6. Показано, что фосфор в Р4О6 координационно ненасыщен, и поэтому является неустойчивым. Взаимодействие Р4О6 с горячей водой приводит к диспропорционированию Р4О6 + 6Н2О = РН3 + ЗН3РО4; Газообразный НСl разлагает Р4О6: Р4О6 + 6НСl = 2Н3РО3 + 2РСl3. Р4О10 активно взаимодействует с водой, а также отнимает ее от других соединений, образуя в зависимости от условий, либо метафосфорную НРО3, либо ортофосфорную Н3РО4, либо пирофосфорную Н4Р2О7 кислоты. Именно поэтому Р4О10 широко используется как осушитель различных веществ от паров воды.
Азот входит в состав земной атмосферы в несвязанном виде в форме двухатомных молекул. Приблизительно 78% всего объема атмосферы приходится на долю азота. Кроме того, азот входит в состав растений и организмов животных в форме белков. Растения синтезируют белки, используя нитраты из почвы. Нитраты образуются там из атмосферного азота и аммонийных соединений, имеющихся в почве. Процесс превращения атмосферного азота в форму, усвояемую растениями и животными, называется связыванием (или фиксацией) азота.
Связывание азота может происходить двумя способами:
1) Во время разряда молний некоторое количество азота и кислорода в атмосфере соединяется с образованием оксидов азота. Они растворяются в воде, образуя разбавленную азотную кислоту, которая в свою очередь образует нитраты в почве.
2) Атмосферный азот превращается в аммиак, который затем под действием бактерий превращается в нитраты, в процессе, называемом нитрификацией. Некоторые
из таких бактерий присутствуют в почве, тогда как другие существуют в узелках корневой системы клубеньковых растений, например клевера.
Нитрозамин. В последнее время наблюдается повышение содержания нитратов в питьевой воде, главным образом по причине усилившегося использования искусственных. азотных удобрений в сельском хозяйстве. Хотя сами нитраты не так уж опасны для взрослых людей, в организме человека они могут превращаться в нитриты. Кроме того, нитраты и нитриты используются для обработки и консервирования многих пищевых продуктов, в том числе ветчины, бекона, солонины, а также некоторых сортов сыра и рыбы. Отдельные ученые полагают, что в организме человека нитраты могут превращаться в нитрозамины:
Известно, что нитрозамины способны вызывать онкологические заболевания у животных. Большинство из нас уже подвержено воздействию нитрозаминов, которые в небольшом количестве находятся в загрязненном воздухе, сигаретном дыму и некоторых пестицидах. Полагают, что нитрозамины могут быть причиной 70-90% случаев онкологических заболеваний, возникновение которых приписывают действию факторов окружающей среды.
(см. скан)
Рис. 15.15. Круговорот азота в природе.
Нитраты также вносятся в почву в форме удобрений. В гл. 13 уже были описаны такие азотсодержащие удобрения, как нитрат кальция нитрат аммония нитрат натрия и нитрат калия .
Растения усваивают нитраты из почвы через свою корневую систему.
После смерти растений и животных их белки разлагаются, образуя соединения аммония. Эти соединения в конце концов превращаются гнилостными бактериями в нитраты, которые остаются в почве, и азот, который возвращается в атмосферу.
Все эти процессы являются составными частями круговорота азота в природе (см. рис. 15.15).
Ежегодно во все мире вырабатывается свыше 50 млн. т азота. Чистый азот наряду с кислородом и другими газами, в том числе аргоном, в промышленных условиях получают с помощью фракционной (дробной) перегонки сжиженного воздуха. Этот процесс включает три стадии. На первой стадии из воздуха удаляют частицы пыли, пары воды и диоксид углерода. Затем воздух сжижают, охлаждая его и сжимая до
высоких давлений. На третьей стадии фракционной перегонкой жидкого воздуха разделяют азот, кислород и аргон.
Приблизительно три четверти всего азота, получаемого ежегодно в Великобритании, превращают в аммиак (см. разд. 7.2), треть которого превращают затем в азотную кислоту (см. ниже).
Азотная кислота имеет ряд важных применений:
1) приблизительно 80% синтезируемой азотной кислоты - для получения удобрения нитрата аммония;
2) в производстве синтетической пряжи, например найлона;
3) для изготовления взрывчатых веществ, например тринитротолуола (тола) или тринитроглицерина (динамита);
4) для нитрования ароматических аминов в производстве красителей.
Нитраты используются для получения удобрений и взрывчатых веществ. Например, порох представляет собой смесь серы, древесного угля и нитрата натрия. Нитрат стронция и нитрат бария применяются в пиротехнике для получения соответственно красных и бледно-зеленых огней.
Тол и динамит. Тол - это сокращенное название тринитротолуола. Динамит содержит тринитроглицерин, которым пропитан кизельгур. Для получения этого и других взрывчатых веществ используется азотная кислота.

Нитрат серебра используется для получения галогенидов серебра, применяемых в фотографии.
Азот используется для создания инертной атмосферы в производстве листового стекла, полупроводников, витамина А, найлона и свинцово-натриевого сплава, который применяется для получения . Жидкий азот используется для хранения в охлажденном состоянии крови, бычьего семени (с целью выведения племенного скота) и некоторых пищевых продуктов.
Фосфор, как и азот, тоже является одним из незаменимых для жизни элементов и входит в состав всех живых организмов. Он содержится в костных тканях и необходим животным в процессах обмена веществ для накопления энергии.
Фосфор обнаруживается в природе в таких минералах, как апатит, в котором содержится фосфат кальция Ежегодно в мире добывают приблизительно 125 млн. т фосфатной руды. Большая ее часть расходуется на производство фосфатных удобрений (см. гл. 13).
Белый фосфор получают из фосфатной руды, прокаливая ее в смеси с коксом и кремнеземом в электрической печи при температуре порядка 1500°С. При этом образуется оксид который затем восстанавливают до белого фосфора путем нагревания в смеси с коксом. Красный фосфор получают, нагревая белый фосфор без доступа воздуха при температуре около 270 °С в течение нескольких суток.
Красный фосфор используется для изготовления спичек. Им покрывают бока спичечного коробка. Спичечные головки изготовляют из калия, оксида марганца (IV) и серы. При трении спички о коробок происходит окисление фосфора. Большая часть белого фосфора, получаемого в настоящее время, расходуется в производстве фосфорной кислоты. Фосфорную кислоту применяют в производстве
нержавеющей стали и для химического полирования сплавов алюминия и меди. Разбавленная фосфорная кислота используется также в пищевой промышленности для регулирования кислотности желеобразных продуктов и безалкогольных напитков.
Чистый фосфат кальция тоже используется в пищевой промышленности, например в составе пекарского порошка. Одним из важнейших фосфатных соединений является триполифосфат натрия . Он используется для получения синтетических моющих средств и других типов умягчителей воды. Полифосфаты используются также для повышения содержания воды в некоторых пищевых продуктах.