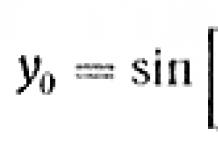Цель: углубить знания учащихся по теме занятия.
Задачи:
- дать характеристику хрома как простого вещества;
- познакомить учащихся с соединениями хрома разной степени окисления;
- показать зависимость свойств соединений от степени окисления;
- показать окислительно – восстановительные свойства соединений хрома;
- продолжить формирование умений учащихся записывать уравнения химических реакций в молекулярном и ионном виде, составлять электронный баланс;
- продолжить формирование умений наблюдать химический эксперимент.
Форма занятия: лекция с элементами самостоятельной работы учащихся и наблюдением за химическим экспериментом.
Ход занятия
I. Повторение материала предыдущего занятия.
1. Ответить на вопросы и выполнить задания:
Какие элементы относятся к подгруппе хрома?
Написать электронные формулы атомов
К какому типу элементов относятся?
Какие степени окисления проявляют в соединениях?
Как изменяется радиус атомов и энергия ионизации от хрома к вольфраму?
Можно предложить заполнить учащимся заполнить таблицу, используя табличные величины радиусов атомов, энергии ионизации и сделать выводы.
Образец таблицы:
2. Заслушать сообщение учащегося по теме «Элементы подгруппы хрома в природе, получение и применение».
II. Лекция.
План лекции:
- Хром.
- Соединения хрома. (2)
- Оксид хрома; (2)
- Гидроксид хрома. (2)
- Соединения хрома. (3)
- Оксид хрома; (3)
- Гидроксид хрома. (3)
- Соединения хрома (6)
- Оксид хрома; (6)
- Хромовая и дихромовая кислоты.
- Зависимость свойств соединений хрома от степени окисления.
- Окислительно – восстановительные свойства соединений хрома.
1. Хром.
Хром – это белый с голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см 3), температура плавления 1890˚С.
Химические свойства: хром при обычных условиях неактивный металл. Это объясняется тем, что его поверхность покрыта оксидной пленкой (Сr 2 О 3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре:
- 4Сr +3О 2 = 2Сr 2 О 3
- 2Сr + 3S = Сr 2 S 3
- 2Сr + 3Cl 2 = 2СrСl 3
Задание: составить уравнения реакций хрома с азотом, фосфором, углеродом и кремнием; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель.
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
- 2Сr + 3 Н 2 О = Сr 2 О 3 + 3Н 2
Задание:
Хром реагирует с разбавленной серной и соляной кислотами:
- Сr + Н 2 SО 4 = СrSО 4 + Н 2
- Сr + 2НСl= СrСl 2 + Н 2
Задание: составить электронный баланс, указать окислитель и восстановитель.
Концентрированные серная соляная и азотная кислоты пассивируют хром.
2. Соединения хрома. (2)
1. Оксид хрома (2) - СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) - Сr(ОН) 2), не растворяется в воде, но растворяется в кислотах:
- СrО + 2НСl = СrСl 2 + Н 2 О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (2) с серной кислотой.
Оксид хрома (2) легко окисляется на воздухе:
- 4СrО+ О 2 = 2Сr 2 О 3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Оксид хрома (2) образуется при окислении амальгамы хрома кислородом воздуха:
2Сr (амальгама) + О 2 = 2СrО
2. Гидроксид хрома (2) - Сr(ОН) 2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами:
- Сr(ОН) 2 + Н 2 SО 4 = СrSO 4 + 2Н 2 О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (2) с соляной кислотой.
Как и оксид хрома (2), гидроксид хрома (2) окисляется:
- 4 Сr(ОH) 2 + О 2 + 2Н 2 О = 4Сr(ОН) 3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Получить гидроксид хрома (2) можно при действии щелочей на соли хрома (2):
- CrCl 2 + 2KOH = Cr(OH) 2 ↓ + 2KCl
Задание: составить ионные уравнения.
3. Соединения хрома. (3)
1. Оксид хрома (3) - Сr 2 О 3 – порошок темно – зеленого цвета, нерастворим в воде, тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома (3) – Сr(ОН) 3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
- Сr 2 О 3 + 2КОН = 2КСrО 2 (хромит К) + Н 2 О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (3) с гидроксидом лития.
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
- Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [Сr(ОН) 6 ]
- Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (3) с конценрированной серной кислотой и концентрированным раствором гидроксида натрия.
Оксид хрома (3) может быть получен при разложении дихромата аммония:
- (NН 4)2Сr 2 О 7 = N 2 + Сr 2 О 3 +4Н 2 О
2. Гидроксид хрома (3) Сr(ОН) 3 получают при действии щелочей на на растворы солей хрома (3):
- СrСl 3 +3КОН = Сr(ОН) 3 ↓ + 3КСl
Задание: составить ионные уравнения
Гидроксид хрома (3) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (3), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
- Сr(ОН) 3 + 3НNО 3 = Сr(NО 3) 3 + 3Н 2 О
- Сr(ОН) 3 + 3КОН = К 3 [Сr(ОН)6](гексагидроксохромит К)
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия гидроксида хрома (3) с соляной кислотой и гидроксидом натрия.
При сплавлении Сr(ОН) 3 со щелочами получаются метахромиты и ортохромиты:
- Cr(OH) 3 + KOH = KCrO 2 (метахромит К) + 2H 2 O
- Cr(OH) 3 + KOH = K 3 CrO 3 (ортохромит К) + 3H 2 O
4. Соединения хрома. (6)
1. Оксид хрома (6) - СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
- СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды)
- СrО 3 + Н 2 О =Н 2 Сr 2 О 7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
- С 2 Н 5 ОН + 4СrО 3 = 2СО 2 + 2Сr 2 О 3 + 3Н 2 О
Окисляет также иод, серу, фосфор, уголь:
- 3S + 4CrO 3 = 3SO 2 + 2Cr 2 O 3
Задание: составить уравнения химических реакций оксида хрома (6) с йодом, фосфором, углем; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель
При нагревании до 250 0 С оксид хрома (6) разлагается:
- 4CrO 3 = 2Cr 2 O 3 + 3O 2
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
- К 2 Сr 2 О 7 + Н 2 SО 4 = К 2 SО 4 + 2СrО 3 + Н 2 О
2. Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат - ионы СrО 4 2- и дихромат – ионы Сr 2О 7 2- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
- 2К 2 СrО 4 + Н 2 SО 4 = К 2 Сr 2 О 7 + К 2 SО 4 + Н 2 О
В щелочной среде дихроматы переходят в хроматы:
- К 2 Сr 2 О 7 + 2КОН = 2К 2 СrО 4 + Н 2 О
При разбавлении дихромовая кислота переходит в хромовую кислоту:
- H 2 Cr 2 O 7 + H 2 O = 2H 2 CrO 4
5. Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr 2 О 3 | СrО 3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН) 2 | Сr(ОН) 3 – Н 3 СrО 3 | Н 2 СrО 4 |
| Характер гидроксида | основной | амфотерный | кислотный |
|
→ ослабление основных свойств и усиление кислотных→ |
|||
6. Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr +6 переходят в соединения Сr +3 под действием восстановителей: H 2 S, SO 2 , FeSO 4
- К 2 Сr 2 О 7 +3Н 2 S +4Н 2 SО 4 = 3S + Сr 2 (SО 4) 3 + K 2 SO 4 + 7Н 2 О
- S -2 – 2e → S 0
- 2Cr +6 + 6e → 2Cr +3
Задание:
1. Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
- Na 2 CrO 4 + K 2 S + H 2 SO 4 = S + Cr 2 (SO 4) 3 + K 2 SO 4 + Na 2 SO 4 + H 2 O
2. Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
- K 2 Cr 2 O 7 + SO 2 + H 2 SO 4 = ? +? +Н 2 О
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr +3 переходят в соединения Сr +6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
- 2KCrO 2 +3 Br 2 +8NaOH =2Na 2 CrO 4 + 2KBr +4NaBr + 4H 2 O
- Cr +3 - 3e → Cr +6
- Br2 0 +2e → 2Br -
Задание:
Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
- NaCrO 2 + J 2 + NaOH = Na 2 CrO 4 + NaJ + H 2 O
Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
- Cr(OH) 3 + Ag 2 O + NaOH = Ag + ? + ?
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr +2 → Сr +3 → Сr +6 . Соединения хрома (2) - сильные восстановители, легко окисляются, превращаясь в соединения хрома (3). Соединения хрома (6) – сильные окислители, легко восстанавливаются в соединения хрома (3). Соединения хрома (3) при взаимодействии с сильными восстановителями проявляют окислительные свойства, переходя в соединения хрома (2), а при взаимодействии с сильными окислителями проявляют восстановительные свойства, превращаясь в соединеня хрома (6)
К методике проведения лекции:
- Для активизации познавательной деятельности учащихся и поддержания интереса, целесообразно в ходе лекции проводить демонстрационный эксперимент. В зависимости от возможностей учебной лаборатории можно демонстрировать учащимся следующие опыты:
- получении оксида хрома (2) и гидроксида хрома (2), доказательство их основных свойств;
- получение оксида хрома (3) и гидроксида хрома (3), доказательство их амфотерных свойств;
- получение оксида хрома (6) и растворение его в воде (получение хромовой и дихромовой кислот);
- переход хроматов в дихроматы, дихроматов в хроматы.
- Задания самостоятельной работы можно дифференцировать с учетом реальных учебных возможностей учащихся.
- Завершить лекцию можно выполнением следующих заданий: напишите уравнения химических реакций с помощью которых можно осуществить следующие превращения:
.III. Домашнее задание: доработать лекцию (дописать уравнения химических реакций)
- Васильева З.Г. Лабораторные работы по общей и неорганической химии. -М.: «Химия», 1979 – 450 с.
- Егоров А.С. Репетитор по химии. – Ростов-на-Дону: «Феникс», 2006.-765 с.
- Кудрявцев А.А. Составление химических уравнений. - М., «Высшая школа», 1979. - 295 с.
- Петров М.М. Неорганическая химия. – Ленинград: «Химия», 1989. – 543 с.
- Ушкалова В.Н. Химия: конкурсные задания и ответы. - М.: «Просвещение», 2000. – 223 с.
Оксид хрома(II ) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
4Cr(OH)+O+ 2HO→4Cr(OH)
Оксид хрома(III ) CrO- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH)-→CrO+ 3HO
4KCrO-→ 2CrO + 4KCrO + 3O
(NH)CrO-→ CrO+ N+ HO
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [Сr(ОН) 6 ]
Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О
Гидроксид хрома (III) Сr(ОН) 3 получают при действии щелочей на на растворы солей хрома (III):
СrСl 3 +3КОН = Сr(ОН) 3 ↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН) 3 + 3НNО 3 = Сr(NО 3) 3 + 3Н 2 О
Сr(ОН) 3 + 3КОН = К 3 [Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН) 3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH) 3 + KOH = KCrO 2 (метахромит К) + 2H 2 O
Cr(OH) 3 + KOH = K 3 CrO 3 (ортохромит К) + 3H 2 O
Соединения хрома(VI ).
Оксид хрома (VI ) - СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды)
СrО 3 + Н 2 О =Н 2 Сr 2 О 7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
С 2 Н 5 ОН + 4СrО 3 = 2СО 2 + 2Сr 2 О 3 + 3Н 2 О
Окисляет также иод, серу, фосфор, уголь:
3S + 4CrO 3 = 3SO 2 + 2Cr 2 O 3
При нагревании до 250 0 С оксид хрома (6) разлагается:
4CrO 3 = 2Cr 2 O 3 + 3O 2
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
К 2 Сr 2 О 7 + Н 2 SО 4 = К 2 SО 4 + 2СrО 3 + Н 2 О
Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат - ионы СrО 4 2- и дихромат – ионы Сr2О 7 2- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
2К 2 СrО 4 + Н 2 SО 4 = К 2 Сr 2 О 7 + К 2 SО 4 + Н 2 О
В щелочной среде дихроматы переходят в хроматы:
К 2 Сr 2 О 7 + 2КОН = 2К 2 СrО 4 + Н 2 О
При разбавлении дихромовая кислота переходит в хромовую кислоту:
H 2 Cr 2 O 7 + H 2 O = 2H 2 CrO 4
Зависимость свойств соединений хрома от степени окисления.
|
Степень окисления | |||
|
Характер оксида |
основной |
амфотерный |
кислотный |
|
Гидроксид |
Сr(ОН) 3 – Н 3 СrО 3 | ||
|
Характер гидроксида |
основной |
амфотерный |
кислотный |
|
→ ослабление основных свойств и усиление кислотных→ |
|||
Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr +6 переходят в соединения Сr +3 под действием восстановителей: H 2 S, SO 2 , FeSO 4
К 2 Сr 2 О 7 +3Н 2 S +4Н 2 SО 4 = 3S + Сr 2 (SО 4) 3 + K 2 SO 4 + 7Н 2 О
S -2 – 2e → S 0
2Cr +6 + 6e → 2Cr +3
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr +3 переходят в соединения Сr +6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
2KCrO 2 +3 Br2 +8NaOH =2Na 2 CrO 4 + 2KBr +4NaBr + 4H 2 O
Cr +3 - 3e → Cr +6
Окислительно-восстановительные свойства соединений хрома с различной степенью окисления.
Хром. Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
Cr +24)2)8)13)1
Для хрома характерны степени окисления +2, +3 и +6.
C увеличением степени окисления возрастают кислотные и окислительные свойства. Хром Производные Сr2+ - очень сильные восстановители. Ион Сr2+ образуется на первой стадии растворения Хрома в кислотах или при восстановлении Сr3+ в кислом растворе цинком. Гидрат закиси Сr(ОН)2 при обезвоживании переходит в Сr2О3. Соединения Сr3+ устойчивы на воздухе. Могут быть и восстановителями и окислителями. Сr3+ можно восстановить в кислом растворе цинком до Сr2+ или окислить в щелочном растворе до СrО42- бромом и других окислителями. Гидрооксид Сr(ОН)3 (вернее Сr2О3·nН2О) - амфотерное соединение, образующее соли с катионом Сr3+ или соли хромистой кислоты НСrО2 - хромиты (например, КСrО2, NaCrO2). Соединения Сr6+: хромовый ангидрид СrО3, хромовые кислоты и их соли, среди которых наиболее важны хроматы и дихроматы - сильные окислители.солей.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов.
Хроматы и дихроматы
Хроматы образуются при взаимодействии СгО3, или растворов хромовых кислот со щелочами:
СгОз + 2NaOH = Na2CrO4 + Н2О
Дихроматы получаются при действии на хроматы кислот:
2 Na2Cr2O4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О
Для соединений хрома характерны окислительно - восстановительные реакции.
Соединения хрома (II) - сильные восстановители, они легкоокисляются
4(5гС12 + О2 + 4HCI = 4СгС1з + 2Н2О
Для соединений хрома (!!!) характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы - в щелочной среде,
в дихроматы - в кислой среде.
Cr(ОН)3. CrOH + HCl = CrCl + H2O, 3CrOH + 2NaOH = Cr3Na2O3 + 3H2O
Хроматы(III) (устар. назв. хромиты).
Для соединений хрома характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы - в щелочной среде,
в дихроматы - в кислой среде.
2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Соли хромовых кислот в кислой среде - сильные окислители:
3Na2SO3 + К2Сг2О7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18/2008
ЗАНЯТИЕ 25
10-й класс (первый год обучения)
Хром и его соединения
1. Положение в таблице Д.И.Менделеева, строение атома.
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения хрома:
а) оксид и гидроксид хрома(II);
б) оксид и гидроксид хрома(III), их амфотерные свойства;
в) оксид хрома(VI), хромовая и дихромовая кислота, хроматы и дихроматы.
9. Окислительно-восстановительные свойства соединений хрома.
Хром расположен в побочной подгруппе VI группы таблицы Д.И.Менделеева. При составлении электронной формулы хрома необходимо вспомнить, что в связи с большей устойчивостью конфигурации 3d 5 у атома хрома наблюдается проскок электрона и электронная формула имеет вид: 1s 2 2s 2 p 6 3s 2 p 6 4s 1 3d 5 . В соединениях хром может проявлять степени окисления +2, +3 и +6 (степень окисления +3 является наиболее устойчивой):
Хром получил свое название от греческого слова chroma (цвет, краска) из-за яркой разнообразной окраски его соединений.
Хром – белый блестящий металл, очень твердый, хрупкий, тугоплавкий. Устойчив к коррозии. На воздухе покрывается оксидной пленкой, из-за чего поверхность становится матовой.
Х и м и ч е с к и е с в о й с т в а
При обычных условиях хром – неактивный металл и реагирует только со фтором. Но при нагревании оксидная пленка хрома разрушается, и хром реагирует со многими простыми и сложными веществами (аналогично Al).
4Cr + 3O 2 2Cr 2 O 3 .
Металлы (–).
Неметаллы (+):
2Cr + 3Cl 2 2CrCl 3 ,
2Cr + 3F 2 = 2CrF 3 ,
2Cr + 3SCr 2 S 3 ,
Н 2 О (+/–):*
2Cr + 3H 2 O (пар)Cr 2 O 3 + 3H 2 .
Основные оксиды (–).
Кислотные оксиды (–).
Основания (+/–):
2Cr + 6NaOH + 6H 2 O = 2Na 3 + 3H 2 .
Кислоты-неокислители (+).
Cr + 2HCl = CrCl 2 + H 2 .
Кислоты-окислители (–). Пассивация.
Соли (+/–):
2Cr + 3CuSO 4 = Cr 2 (SO 4) 3 + 3Cu,
Cr + CaCl 2 нет реакции.
В п р и р о д е элемент хром представлен четырьмя изотопами с массовыми числами 50, 52, 53 и 54. В природе хром встречается только в виде соединений, важнейшими из которых являются хромистый железняк, или хромит (FeOжCr 2 O 3) и свинцовая красная руда (PbCrO 4).
Металлический хром получают: 1) из его оксида с помощью алюмотермии:
Cr 2 O 3 + 2Al 2Cr + Al 2 O 3 ,
2) электролизом водных растворов или расплавов его солей:

Из хромистого железняка в промышленности получают сплав железа с хромом – феррохром, широко используемый в металлургии:
FeO Cr 2 O 3 + 4CFe + 2Cr + 4CO.
В а ж н е й ш и е с о е д и н е н и я х р о м а
Хром образует три оксида и соответствующих им гидроксида, характер которых закономерно изменяется с увеличением степени окисления хрома:

Оксид хрома (II) (CrO) – твердое, не растворимое при обычных условиях в воде вещество ярко-красного или коричнево-красного цвета, типичный основной оксид. Оксид хрома(II) легко окисляется на воздухе при нагревании, восстанавливается до чистого хрома.
CrO + 2HCl = CrCl 2 + H 2 O,
4CrO + O 2 2Сr 2 O 3 ,
CrO + H 2 Сr + H 2 O.
Получают оксид хрома(II) прямым окислением хрома:
2Cr + O 2 2СrO.
Гидроксид хрома (II) (Cr(OH) 2) – нерастворимое в воде вещество желтого цвета, слабый электролит, проявляет основные свойства, хорошо растворяется в концентрированных кислотах; легко окисляется в присутствии влаги кислородом воздуха; при прокаливании на воздухе разлагается с образованием оксида хрома(III):
Cr(OH) 2 + 2HCl = CrCl 2 + 2H 2 O,
4Cr(OH) 2 + O 2 2Сr 2 O 3 + 4H 2 O.
Получают гидроксид хрома(II) реакцией обмена между солью хрома(II) и раствором щелочи в отсутствие кислорода:
CrCl 2 + 2NaOH = Cr(OH) 2 + 2NaCl.
Оксид хрома (III) (Cr 2 O 3) проявляет амфотерные свойства. Это тугоплавкий (по твердости сравним с корундом) порошок зеленого цвета, не растворяется в воде. Канцероген! Получают его при разложении дихромата аммония, гидроксида хрома(III), восстановлением дихромата калия или прямым окислением хрома:
(NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4H 2 O,
2Cr(OH) 3 Cr 2 O 3 + 3H 2 O,
2K 2 Cr 2 O 7 + 3С2Cr 2 O 3 + 2K 2 CO 3 + СO 2 ,
4Cr + 3O 2 2Cr 2 O 3 .
При обычных условиях оксид хрома(III) плохо растворяется в кислотах и щелочах; амфотерные свойства он проявляет при сплавлении со щелочами или с карбонатами щелочных металлов (образуя хромиты); при высоких температурах оксид хрома(III) можно восстановить до чистого металла:
Cr 2 O 3 + 2KOH 2KCrO 2 + H 2 O,
Cr 2 O 3 + Na 2 CO 3 2NaCrO 2 + CO 2 ,
Cr 2 O 3 + 6HCl = 2CrCl 3 + 3H 2 O,
2Cr 2 O 3 + 3С4Cr + 3СO 2 .
Гидроксид хрома (III) (Cr(OH) 3) осаждается при действии щелочей на соли трехвалентного хрома (серо-зеленый осадок):
CrCl 3 + 3NaOH (недостаток) = Сr(OH) 3 + 3NaCl.
Он проявляет амфотерные свойства, растворяясь как в кислотах, так и в избытке щелочей; термически неустойчив:
Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O,
Cr(OH) 3 + 3KOH = K 3 ,
Cr(OH) 3 + KOH KCrO 2 + 2H 2 O,
2Cr(OH) 3 Cr 2 O 3 + 3H 2 O.
Оксид хрома (VI) (CrO 3) – кристаллическое вещество темно-красного цвета, ядовит, проявляет кислотные свойства. Хорошо растворим в воде, при растворении этого оксида в воде образуются хромовые кислоты; как кислотный оксид CrO 3 взаимодействует с основными оксидами и со щелочами; термически неустойчив; является сильнейшим окислителем:
CrO 3 + H 2 O =
2CrO 3 + H 2 O =
CrO 3 + K 2 OK 2 CrO 4 ,
CrO 3 + 2NaOH = Na 2 CrO 4 + H 2 O,
4CrO 3 2Cr 2 O 3 + 3O 2 ,

Получают этот оксид взаимодействием сухих хроматов и дихроматов с концентрированной серной кислотой:
K 2 Cr 2 O 7 + H 2 SO 4 (конц.)2CrO 3 + K 2 SO 4 + H 2 O,
K 2 CrO 4 + H 2 SO 4 (конц.)CrO 3 + K 2 SO 4 + H 2 O.
Хромовая и дихромовая кислоты существуют только в водных растворах, но образуют устойчивые соли – хроматы и дихроматы . Хроматы и их растворы имеют желтую окраску, а дихроматы – оранжевую. Хромат-ионы и дихромат-ионы легко переходят друг в друга при изменении среды раствора. В кислой среде хроматы переходят в дихроматы, раствор приобретает оранжевую окраску; в щелочной среде дихроматы переходят в хроматы, раствор становится желтым:
2K 2 CrO 4 + H 2 SO 4)K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O,
K 2 Cr 2 O 7 + 2KOH)2K 2 CrO 4 + H 2 O.
Ион устойчив в щелочной среде, а – в кислой.
О к и с л и т е л ь н о–в о с с т а н о в и т
е л ь н ы е с в о й с т в а
с о е д и н е н и й х р о м а
Из всех соединений хрома наиболее устойчивыми являются соединения со степенью окисления хрома +3. Соединения хрома со степенью окисления +2 являются сильными восстановителями и легко окисляются до +3:
4Cr(OH) 2 + O 2 + 2H 2 O = 4Cr(OH) 3 ,
4CrCl 2 + 4HCl + O 2 = 4CrCl 3 + 2H 2 O.
Соединения, содержащие хром в степени окисления +6, являются сильными окислителями, хром при этом восстанавливается от +6 до +3:
K 2 Cr 2 O 7 + 3H 2 S + 4H 2 SO 4 = 3S + Cr 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O.
Для обнаружения спирта в выдыхаемом воздухе используется реакция, основанная на окислительной способности оксида хрома(VI):
4CrO 3 + 3С 2 H 5 OH 2Cr 2 O 3 + 3CH 3 COOH + 3H 2 O.
Раствор дихромата калия в концентрированной серной кислоте называют хромовой смесью и используют для очистки химической посуды.
Тест по теме «Хром и его соединения»
1. Некоторый элемент образует все три типа оксидов (основный, амфотерный и кислотный). Степень окисления элемента в амфотерном оксиде будет:
а) минимальной;
б) максимальной;
в) промежуточной между минимальной и максимальной;
г) может быть любой.
2. При взаимодействии свежеприготовленного осадка гидроксида хрома(III) с избытком раствора щелочи образуется:
а) средняя соль; б) основная соль;
в) двойная соль; г) комплексная соль.
3. Общее число электронов на предвнешнем уровне атома хрома составляет:
а) 12; б) 13; в) 1; г) 2.
4. Какой из оксидов металлов относится к кислотным?
а) Оксид меди(II); б) оксид хрома(VI);
в) оксид хрома(III); г) оксид железа(III).
5. Какая масса дихромата калия (в г) необходима для окисления 11,2 г железа в сернокислом растворе?
а) 58,8; б) 14,7; в) 294; г) 29,4.
6. Какую массу воды (в г) необходимо выпарить из 150 г 10%-го раствора хлорида хрома(III) для получения 30%-го раствора этой соли?
а) 100; б) 20; в) 50; г) 40.
7. Молярная концентрация серной кислоты в растворе равна 11,7 моль/л, а плотность раствора составляет 1,62 г/мл. Массовая доля серной кислоты в этом растворе равна (в %):
а) 35,4; б) 98; в) 70,8; г) 11,7.
8. Число атомов кислорода в 19,4 г хромата калия равно:
а) 0,602 10 23 ; б) 2,408 10 23 ;
в) 2,78 10 23 ; г) 6,02 10 23 .
9. Лакмус покажет красную окраску в водном растворе (возможно несколько правильных ответов):
а) хлорида хрома(III); б) хлорида хрома(II);
в) хлорида калия; г) соляной кислоты.
10. Переход хромата в дихромат происходит в … среде и сопровождается процессом:
а) кислая, процесс восстановления;
б) кислая, не происходит изменения степеней окисления;
в) щелочная, процесс восстановления;
г) щелочная, не происходит изменения степеней окисления.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | г | б | б | г | а | в | б | а, б, г | б |
Качественные задачи по идентификации веществ 1. Водный раствор некоторой соли разделили на две части. Одну из них обработали избытком щелочи и нагрели, выделившийся газ изменил цвет красного лакмуса на синий. Другую часть обработали соляной кислотой, выделившийся газ вызвал помутнение известковой воды. Какую соль подвергли анализу? Подтвердите свой ответ уравнениями реакций.
Ответ . Карбонат аммония.
2. При добавлении к водному раствору вещества А (раздельно) аммиака, сульфида натрия и нитрата серебра образуются белые осадки, причем два из них - одинакового состава. Что собой представляет вещество А? Напишите уравнения реакций.
Решение
Вещество А – AlCl 3 .
AlCl 3 + 3NH 4 OH = Al(OH) 3 + 3NH 4 Cl,
2AlCl 3 + 3Na 2 S + 6H 2 O 2Al(OH) 3 + 3H 2 S + 6NaCl,
AlCl 3 + 3AgNO 3 = 3AgCl + Al(NO 3) 3 .
Ответ . Хлорид алюминия.
3. При сгорании в присутствии кислорода бесцветного газа А с резким характерным запахом образуется другой газ В, без цвета и запаха, реагирующий при комнатной температуре с литием с образованием твердого вещества С. Идентифицируйте вещества, напишите уравнения реакций.
Решение
Вещество А – NH 3 ,
вещество В – N 2 ,
вещество С – Li 3 N.
4NH 3 + 3O 2 2N 2 + 6H 2 O,
N 2 + 6Li = 2Li 3 N.
Ответ . NH 3 , N 2 , Li 3 N.
4. Бесцветный газ А с характерным резким запахом реагирует с другим бесцветным газом В, имеющим запах тухлых яиц. В результате реакции образуется простое С и сложное вещество. Вещество С взаимодействует с медью с образованием соли черного цвета. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . SO 2 , H 2 S, S.
5. Бесцветный газ А с резким характерным запахом, легче воздуха, реагирует с сильной кислотой В, при этом образуется соль С, водный раствор которой не образует осадков ни с хлоридом бария, ни с нитратом серебра. Идентифицируйте вещества, приведите уравнения реакций (один из возможных вариантов).
Ответ . NH 3 , HNO 3 , NH 4 NO 3 .
6. Простое вещество А, образованное атомами второго по распространенности элемента земной коры, реагирует при нагревании с оксидом железа(II), в результате чего образуется соединение В, нерастворимое в водных растворах щелочей и кислот (кроме плавиковой). Вещество В при сплавлении с негашеной известью образует нерастворимую соль С. Идентифицируйте вещества, приведите уравнения реакций (один из возможных вариантов).
Ответ . Si, SiO 2 , CaSiO 3 .
7. Нерастворимое в воде соединение А бурого цвета при нагревании разлагается с образованием двух оксидов, один из которых – вода. Другой оксид В восстанавливается углем с образованием металла С, вторым по распространенности в природе металлом. Идентифицируйте вещества, напишите уравнения реакций.
Ответ . Fe(OH) 3 , Fe 2 O 3 , Fe.
8. Вещество А, входящее в состав одного из самых распространенных минералов, при обработке соляной кислотой образует газ В. При взаимодействии вещества В при нагревании с простым веществом С образуется только одно соединение – горючий газ без цвета и запаха. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . CaCO 3 , CO 2 , C.
9. Легкий металл А, реагирующий с разбавленной серной кислотой, но не реагирующий на холоде с концентрированной серной кислотой, взаимодействует с раствором гидроксида натрия, при этом образуются газ и соль В. При добавлении к веществу В соляной кислоты образуется соль С. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . Al, NaAlO 2 , NaCl.
10. Вещество А представляет собой мягкий, хорошо режущийся ножом серебристо-белый металл, легче воды. При взаимодействии вещества А с простым веществом В образуется соединение С, растворимое в воде с образованием щелочного раствора. При обработке вещества С соляной кислотой выделяется газ с неприятным запахом и образуется соль, окрашивающая пламя горелки в фиолетовый цвет. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . K, S, K 2 S.
11. Бесцветный газ А с резким характерным запахом окисляется кислородом в присутствии катализатора в соединение В, представляющее собой летучую жидкость. Вещество В, вступая в реакцию с негашеной известью, образует соль С. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . SO 2 , SO 3 , CaSO 4 .
12. Простое вещество А, жидкое при комнатной температуре, реагирует с серебристо-белым легким металлом В, образуя соль С, которая при обработке раствором щелочи дает белый осадок, растворяющийся в избытке щелочи. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . Br 2 , Al, AlBr 3 .
13. Твердое простое вещество А желтого цвета реагирует с серебристо-белым легким металлом В, в результате чего образуется соль С, полностью гидролизующаяся в водном растворе с образованием белого осадка и ядовитого газа с неприятным запахом. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . S, Al, Al 2 S 3 .
14. Простое неустойчивое газообразное вещество А превращается в другое простое вещество В, в атмосфере которого сгорает металл С; продуктом этой реакции является оксид, в котором металл находится в двух степенях окисления. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . O 3 , O 2 , Fe.
15. Кристаллическое вещество темно-фиолетового цвета А при нагревании разлагается с образованием простого газообразного вещества В, в атмосфере которого сгорает простое вещество С, образуя бесцветный газ без запаха, входящий в небольших количествах в состав воздуха. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . KMnO 4 , O 2 , C.
16. Простое вещество А, являющееся полупроводником, реагируя с простым газообразным веществом В, образует соединение С, не растворяющееся в воде. При сплавлении со щелочами вещество С образует соединения, называемые растворимыми стеклами. Идентифицируйте вещества, приведите уравнения реакций (один из возможных вариантов).
Ответ . Si, O 2 , SiO 2 .
17. Ядовитый бесцветный газ А с неприятным запахом разлагается при нагревании на простые вещества, одно из которых В представляет собой твердое вещество желтого цвета. При сгорании вещества В образуется бесцветный газ С с неприятным запахом, обесцвечивающий многие органические краски. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . H 2 S, S, SO 2 .
18. Летучее водородное соединение А сгорает в воздухе, образуя вещество В, растворимое в плавиковой кислоте. При сплавлении вещества В с оксидом натрия образуется растворимая в воде соль С. Идентифицируйте вещества, приведите уравнения реакций.
Ответ . SiH 4 , SiO 2 , Na 2 SiO 3 .
19. Труднорастворимое в воде соединение А белого цвета в результате прокаливания при высокой температуре с углем и песком в отсутствие кислорода образует простое вещество В, существующее в нескольких аллотропных модификациях. При сгорании этого вещества в воздухе образуется соединение С, растворяющееся в воде с образованием кислоты, способной образовывать три ряда солей. Идентифицируйте вещества, напишите уравнения реакций.
Ответ . Ca 3 (PO 4) 2 , P, P 2 O 5 .
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
Продолжение следует
Хром - элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром- твёрдый металл голубовато-белого цвета.
Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O 2 – t° →2Cr 2 O 3
2Cr + 3Cl 2 – t° → 2CrCl 3
2Cr + N 2 – t° → 2CrN
2Cr + 3S – t° → Cr 2 S 3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H 2 O → Cr 2 O 3 + 3H 2
Хром растворяется в разбавленных сильных кислотах (HCl, H 2 SO 4)
В отсутствии воздуха образуются соли Cr 2+ , а на воздухе – соли Cr 3+ .
Cr + 2HCl → CrCl 2 + H 2
2Cr + 6HCl + O 2 → 2CrCl 3 + 2H 2 O + H 2
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH) 2 + 2HCl → CrCl 2 + 2H 2 O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl 2 + 2HCl → 2CrCl 3 + H 2
4Cr(OH) 2 + O 2 + 2H 2 O → 4Cr(OH) 3
Оксид хрома (III) Cr 2 O 3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH) 3 – t° → Cr 2 O 3 + 3H 2 O
4K 2 Cr 2 O 7 – t° → 2Cr 2 O 3 + 4K 2 CrO 4 + 3O 2
(NH 4) 2 Cr 2 O 7 – t° → Cr 2 O 3 + N 2 + 4H 2 O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr 2 O 3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr 2 O 3 + 2NaOH → 2NaCrO 2 + H 2 O
Cr 2 O 3 + Na 2 CO 3 → 2NaCrO 2 + CO 2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr 2 O 3 + 4KOH + KClO 3 → 2K 2 CrO 4 + KCl + 2H 2 O
Гидроксид хрома (III) С r (ОН) 3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH) 3 + 3H 2 SO 4 → Cr 2 (SO 4) 3 + 6H 2 O Сr(ОН) 3 + ЗН + = Сr 3+ + 3H 2 O
Cr(OH) 3 + KOH → K , Сr(ОН) 3 + ЗОН — (конц.) = [Сr(ОН) 6 ] 3-
Cr(OH) 3 + KOH → KCrO 2 +2H 2 O Сr(ОН) 3 + МОН = МСrO 2(зел.) + 2Н 2 O (300-400 °С, М = Li, Na)
Сr(ОН) 3 →(120 o C – H 2 O ) СrO(ОН) →(430-1000 0 С – H 2 O ) Cr 2 O 3
2Сr(ОН) 3 + 4NаОН (конц.) + ЗН 2 O 2(конц.) =2Na 2 СrO 4 + 8Н 2 0
Получение : осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr 3+ + 3(NH 3 Н 2 O) = С r (ОН) 3 ↓ + ЗNН 4+
Cr 2 (SO 4) 3 + 6NaOH → 2Cr(OH) 3 ↓+ 3Na 2 SO 4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr +3 Cl 3 → 2Cr +2 Cl 2 + ZnCl 2
2Cr +3 Cl 3 + 16NaOH + 3Br 2 → 6NaBr + 6NaCl + 8H 2 O + 2Na 2 Cr +6 O 4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO 3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H 2 SO 4 (конц.).
K 2 CrO 4 + H 2 SO 4 → CrO 3 + K 2 SO 4 + H 2 O
K 2 Cr 2 O 7 + H 2 SO 4 → 2CrO 3 + K 2 SO 4 + H 2 O
CrO 3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO 4 2- :
CrO 3 + 2KOH → K 2 CrO 4 + H 2 O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr 2 O 7 2- :
2K 2 CrO 4 + H 2 SO 4 → K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O
В щелочной среде эта реакция протекает в обратном направлении:
K 2 Cr 2 O 7 + 2KOH → 2K 2 CrO 4 + H 2 O
Дихромат калия – окислитель в кислой среде:
К 2 Сr 2 O 7 + 4H 2 SO 4 + 3Na 2 SO 3 = Cr 2 (SO 4) 3 + 3Na 2 SO 4 + K 2 SO 4 + 4H 2 O
K 2 Cr 2 O 7 + 4H 2 SO 4 + 3NaNO 2 = Cr 2 (SO 4) 3 + 3NaNO 3 + K 2 SO 4 + 4H 2 O
K 2 Cr 2 O 7 + 7H 2 SO 4 + 6KI = Cr 2 (SO 4) 3 + 3I 2 + 4K 2 SO 4 + 7H 2 O
K 2 Cr 2 O 7 + 7H 2 SO 4 + 6FeSO 4 = Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O
Хромат калия К 2 Cr О 4 . Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO 4 2-), незначительно гидролизуется по аниону. В кислотной среде переходит в К 2 Cr 2 O 7 . Окислитель (более слабый, чем К 2 Cr 2 O 7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO 4 2- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K 2 CrO 4 +H 2 SO 4(30%)= K 2 Cr 2 O 7 +K 2 SO 4 +H 2 O
2K 2 CrO 4(т) +16HCl (кон ц., гор.) =2CrCl 3 +3Cl 2 +8H 2 O+4KCl
2K 2 CrO 4 +2H 2 O+3H 2 S=2Cr(OH) 3 ↓+3S↓+4KOH
2K 2 CrO 4 +8H 2 O+3K 2 S=2K[Сr(ОН) 6 ]+3S↓+4KOH
2K 2 CrO 4 +2AgNO 3 =KNO 3 +Ag 2 CrO 4(красн.) ↓
Качественная реакция:
К 2 СгO 4 + ВаСl 2 = 2КСl + ВаCrO 4 ↓
2ВаСrO 4 (т)+ 2НСl (разб.) = ВаСr 2 O 7(p) + ВаС1 2 + Н 2 O
Получение : спекание хромита с поташом на воздухе:
4(Сr 2 Fe ‖‖)O 4 + 8К 2 CO 3 + 7O 2 = 8К 2 СrO 4 + 2Fе 2 O 3 + 8СO 2 (1000 °С)
Дихромат калия K 2 Cr 2 O 7 . Оксосоль. Техническое название хромпик . Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr 2 O 7 2-). В щелочной среде образует К 2 CrO 4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н 2 O 2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н 2 SO 4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К 2 Cr 2 O 7 =4K 2 CrO 4 +2Cr 2 O 3 +3O 2 (500-600 o C)
K 2 Cr 2 O 7 (т) +14HCl (кон ц) =2CrCl 3 +3Cl 2 +7H 2 O+2KCl (кипячение)
K 2 Cr 2 O 7 (т) +2H 2 SO 4(96%) ⇌2KHSO 4 +2CrO 3 +H 2 O (“хромовая смесь”)
K 2 Cr 2 O 7 +KOH (конц) =H 2 O+2K 2 CrO 4
Cr 2 O 7 2- +14H + +6I — =2Cr 3+ +3I 2 ↓+7H 2 O
Cr 2 O 7 2- +2H + +3SO 2(г) =2Cr 3+ +3SO 4 2- +H 2 O
Cr 2 O 7 2- +H 2 O +3H 2 S (г) =3S↓+2OH — +2Cr 2 (OH) 3 ↓
Cr 2 O 7 2- (конц) +2Ag + (разб.) =Ag 2 Cr 2 O 7 (т. красный) ↓
Cr 2 O 7 2- (разб.) +H 2 O +Pb 2+ =2H + + 2PbCrO 4 (красный) ↓
K 2 Cr 2 O 7(т) +6HCl+8H 0 (Zn)=2CrCl 2(син) +7H 2 O+2KCl
Получение: обработка К 2 СrO 4 серной кислотой:
2К 2 СrO 4 + Н 2 SO 4 (30%) = К 2 Cr 2 O 7 + К 2 SO 4 + Н 2 O